
【題目】某小組同學探究物質的溶解度大小與沉淀轉化方向之間的關系。已知:

(1)探究BaCO3和BaSO4之間的轉化,實驗操作:
試劑A | 試劑B | 試劑C | 加入鹽酸后的現象 | |
實驗Ⅰ | BaCl2 | Na2CO3 | Na2SO4 | …… |
實驗Ⅱ | Na2SO4 | Na2CO3 | 有少量氣泡產生,沉淀部分溶解 |
①實驗Ⅰ說明BaCO3全部轉化為BaSO4,依據的現象是加入鹽酸后,__________
②實驗Ⅱ中加入稀鹽酸后發生反應的離子方程式是_______。
③實驗Ⅱ說明沉淀發生了部分轉化,結合BaSO4的沉淀溶解平衡解釋原因:______
(2)探究AgCl和AgI之間的轉化,實驗Ⅲ:
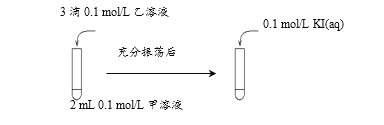
實驗Ⅳ:在試管中進行溶液間反應時,同學們無法觀察到AgI轉化為AgCl,于是又設計了如下實驗(電壓表讀數:a>c>b>0)。

注:其他條件不變時,參與原電池反應的氧化劑(或還原劑)的氧化性(或還原性)越強,原電池的電壓越大;離子的氧化性(或還原性)強弱與其濃度有關。
① 實驗Ⅲ證明了AgCl轉化為AgI,甲溶液可以是______(填序號)。
a. AgNO3溶液 b. NaCl溶液 c. KI溶液
② 實驗Ⅳ的步驟ⅰ中,B中石墨上的電極反應式是 _______________
③ 結合信息,解釋實驗Ⅳ中b<a的原因:______。
④ 實驗Ⅳ的現象能說明AgI轉化為AgCl,理由是_______
【答案】沉淀不溶解或無明顯現象 BaCO3 + 2H+ === Ba2+ + CO2↑+ H2O BaSO4在溶液中存在BaSO4(s) ![]() Ba2+(aq) +SO42- (aq),當加入濃度較高的Na2CO3溶液,CO32-與Ba2+結合生成BaCO3沉淀,使上述平衡向右移動 b 2I- - 2e- === I2 由于生成AgI沉淀使B的溶液中c(I-)減小,I-還原性減弱 實驗ⅳ表明Cl-本身對該原電池電壓無影響,則c>b說明加入Cl-使c(I-)增大,證明發生了AgI + Cl-
Ba2+(aq) +SO42- (aq),當加入濃度較高的Na2CO3溶液,CO32-與Ba2+結合生成BaCO3沉淀,使上述平衡向右移動 b 2I- - 2e- === I2 由于生成AgI沉淀使B的溶液中c(I-)減小,I-還原性減弱 實驗ⅳ表明Cl-本身對該原電池電壓無影響,則c>b說明加入Cl-使c(I-)增大,證明發生了AgI + Cl- ![]() AgCl + I-
AgCl + I-
【解析】
(1) ①BaCO3與鹽酸反應放出二氧化碳氣體, BaSO4不溶于鹽酸;
②實驗Ⅱ中加入稀鹽酸后有少量氣泡產生,是BaCO3與鹽酸反應放出二氧化碳;
③實驗Ⅱ 中加入試劑Na2CO3后,發生反應是BaSO4+ CO32-= BaSO4+ SO42-,根據離子濃度對平衡的影響分析作答;
(2) ①要證明AgCl轉化為AgI, AgNO3與NaCl溶液反應時,必須是NaCl過量;
②I―具有還原性、Ag+具有氧化性,B中石墨是原電池負極;
③B 中滴入AgNO3(aq)生成AgI沉淀;
④AgI轉化為AgCl,則c(I-)增大,還原性增強,電壓增大。
①因為BaCO3能溶于鹽酸,放出CO2氣體,BaSO4不溶于鹽酸,所以實驗Ⅰ說明全部轉化為BaSO4,依據的現象是加入鹽酸后,沉淀不溶解或無明顯現象;
② 實驗Ⅱ是BaCl2中加入Na2SO4和Na2CO3產生BaSO4和BaCO3,再加入稀鹽酸有少量氣泡產生,沉淀部分溶解,是BaCO3和鹽酸發生反應產生此現象,所以反應的離子方程式為:BaCO3 + 2H+ = Ba2+ + CO2↑+ H2O;
③ 由實驗Ⅱ知A溶液為3滴0.1mol/LBaCl2,B為2mL0.1mol/L的Na2SO4溶液,根據Ba2++ SO42-= BaSO4![]() ,所以溶液中存在著BaSO4 (s)
,所以溶液中存在著BaSO4 (s) ![]() Ba2+(aq)+ SO42-(aq),當加入濃度較高的Na2CO3溶液,CO32-與Ba2+結合生成BaCO3沉淀,使上述平衡向右移動。所以BaSO4沉淀也可以轉化為BaCO3沉淀。答案:BaSO4在溶液中存在BaSO4(s)
Ba2+(aq)+ SO42-(aq),當加入濃度較高的Na2CO3溶液,CO32-與Ba2+結合生成BaCO3沉淀,使上述平衡向右移動。所以BaSO4沉淀也可以轉化為BaCO3沉淀。答案:BaSO4在溶液中存在BaSO4(s) ![]() Ba2+(aq)+ SO42-(aq),當加入濃度較高的Na2CO3溶液,CO32-與Ba2+結合生成BaCO3沉淀,使上述平衡向右移動。
Ba2+(aq)+ SO42-(aq),當加入濃度較高的Na2CO3溶液,CO32-與Ba2+結合生成BaCO3沉淀,使上述平衡向右移動。
(2)①甲溶液可以是NaCl溶液,滴入少量的AgNO3溶液后產生白色沉淀,再滴入KI溶液有黃色沉淀產生。說明有AgCl轉化為AgI,故答案為:b;
② 實驗Ⅳ的步驟ⅰ中,B中為0.01mol/L的KI溶液,A中為0.1mol/L的AgNO3溶液,Ag+具有氧化性,作原電池的正極,I-具有還原性,作原電池的負極,所以B中石墨上的電極反應式是2I- - 2e- = I2;
③ 由于AgI的溶解度小于AgCl,B中加入AgNO3溶液后,產生了AgI沉淀,使B的溶液中c(I-)減小,I-還原性減弱,根據已知其他條件不變時,參與原電池反應的氧化劑(或還原劑)的氧化性(或還原性)越強,原電池的電壓越大,而離子的濃度越大,離子的氧化性(或還原性)強。 所以實驗Ⅳ中b<a。答案:由于生成AgI沉淀使B的溶液中c(I-)減小,I-還原性減弱 。
④雖然AgI的溶解度小于AgCl,但實驗Ⅳ中加入了NaCl(s),原電池的電壓c>b,說明c(Cl-)的濃度增大,說明發生了AgI + Cl- ![]() AgCl + I-反應,平衡向右移動,c(I-)增大,故答案為:實驗ⅳ表明Cl-本身對該原電池電壓無影響,則c>b說明加入Cl-使c(I-)增大,證明發生了AgI + Cl-
AgCl + I-反應,平衡向右移動,c(I-)增大,故答案為:實驗ⅳ表明Cl-本身對該原電池電壓無影響,則c>b說明加入Cl-使c(I-)增大,證明發生了AgI + Cl- ![]() AgCl + I-。
AgCl + I-。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】向FeI2、FeBr2的混合溶液中通入適量氯氣,溶液中某些離子的物質的量變化情況如圖所示.則下列說法中不正確的是

A.還原性:I->Fe2+>Br-
B.原混合溶液中FeBr2的物質的量為3mol
C.線段AB表示Fe2+被氯氣氧化
D.原溶液中:n(Fe2+):n(I-):n(Br-)═2:1:3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋅錳干電池是最早的實用電池。現用下列工藝回收正極材料中的金屬(部分條件未給出)。

(1)堿性鋅錳電池反應為:Zn+2MnO2+2H2O=Zn(OH)2+2MnO(OH),電解質是KOH, MnO(OH)中Mn的化合價為:_____,正極反應式為:__________。
(2)黑粉的主要成份為 MnO2和石墨,寫出反應①的化學方程式:________
(3)MnO2的轉化率與溫度的關系如下表:
溫度/℃ | 20 | 40 | 60 | 80 | 100 |
轉化率/℃ | 86.0 | 90.0 | 91.3 | 92.0 | 92.1 |
生產中常選反應溫度為80℃,其理由是:___________。
(4)“沉錳”過程中生成堿式碳酸錳[MnCO36Mn(OH)25H2O],寫出其離子反應方程式:_______。濾液③中可回收的物質為:________(填化學式)。
(5)用硫酸酸化的![]() 漿液可吸收工業廢氣中的
漿液可吸收工業廢氣中的![]() 生成
生成![]() ,已知漿液中
,已知漿液中![]() 含量為
含量為![]() ,工業廢氣中
,工業廢氣中![]() 含量為
含量為![]() ,
, ![]() 的吸收率可達90%,則處理1000
的吸收率可達90%,則處理1000![]() 工業尾氣,可得到
工業尾氣,可得到![]() 的質量為____kg(用含字母的代數式表示)。
的質量為____kg(用含字母的代數式表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子方程式書寫正確的是
A.銅粉加入氯化鐵溶液中:Cu + Fe3+ = Fe2++Cu2+
B.將稀硫酸滴在銅片上:Cu + 2H+ =Cu2++ H2↑
C.氯氣與燒堿溶液反應:Cl2+2OH-=ClO-+Cl-+H2O
D.將少量銅屑放入稀硝酸中:Cu+4H++2NO![]() = Cu2++2NO2↑+2H2O
= Cu2++2NO2↑+2H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】N2(g)與H2(g)在一定條件下經歷如下過程生成NH3(g)。下列說法正確的是

A.I中破壞的均為極性鍵
B.Ⅱ、Ⅲ、Ⅳ均為吸熱過程
C.Ⅳ中NH2與H2生成NH3
D.該條件下生成1molNH3放熱54kJ
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、W、D、E為短周期元素,且原子序數依次增大,質子數之和為39,B、W同周期,A、D同主族,A、W能形成兩種液態化合物A2W和A2W2,E元素的周期序數與主族序數相等。
(1)E元素在周期表中的位置為_____________。
(2)由A、B、W三種元素組成的18電子微粒的電子式為______________。
(3)若要比較D與E的金屬性強弱,下列實驗方法可行的是____________。
A. 將單質D置于E的鹽溶液中,若D不能置換出單質E,說明D的金屬性弱
B. 比較D和E的最高價氧化物對應水化物的堿性,前者比后者強,故前者金屬性強
C. 將D、E的單質分別投入到同濃度的鹽酸中,觀察到D反應更劇烈,說明D的金屬性強
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有機物A可用作果實催熟劑。某同學欲以A為主要原料合成乙酸乙酯,其合成路線如圖所示。
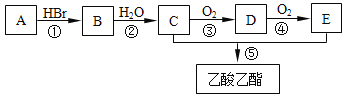
請回答:
(1)C分子中含有的官能團名稱是___________; C的同分異構體的核磁共振氫譜只有一種類型氫原子的吸收峰,其結構簡式是___________。
(2)反應①的反應類型是_________反應,反應 ②~⑤ 中反應類型相同的是_______和_______、_________和________(填序號)。
(3)由A可以直接轉化為C,其反應的化學方程式是___________。
(4)反應②的化學方程式是____________,反應⑤的化學方程式是______。
(5)為了檢驗B中的溴元素,以下操作合理的順序是________(填序號)。
a.加AgNO3 溶液 b.加NaOH 溶液 c.加熱 d.加稀硝酸至溶液顯酸性
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是實驗室制備SO2并驗證SO2某些性質的裝置圖。試回答:

(1)寫出儀器A的名稱___,寫出此實驗中制備SO2化學方程式___。
(2)C中的現象是___,此實驗證明SO2是___氣體。
(3)D中的反應現象證明SO2有___性;F中的現象是___,G中SO2與碘水反應的方程式:___。
(4)H中的試劑是氫氧化鈉溶液,用于吸收多余的二氧化硫氣體,防止污染空氣;反應的離子方程式為___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】LED產品的使用為城市增添色彩。下圖是氫氧燃料電池驅動LED發光的一種裝置示意圖。下列有關敘述正確的是( )
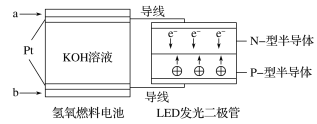
A.a處通入氧氣,b處通入氫氣
B.通入H2的電極發生反應:H2-2e-=2H+
C.通入O2的電極為電池的正極
D.該裝置將化學能最終轉化為電能
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com