
【題目】下列說法正確的是( )
A.銅、石墨均能導電,所以它們均是電解質
B.NH3、CO2的水溶液均能導電,所以NH3、CO2均是電解質
C.將25gCuSO4.5H2O晶體加水配成100mL溶液,該溶液的物質的量濃度為1mol/L
D.實驗室要用容量瓶配制0.2mol/L的NaCl溶液950mL,應稱量NaCl固體11.1g
【答案】C
【解析】解:A、銅、石墨屬于單質,既不是電解質也不是非電解質,故A錯誤;
B、NH3、CO2的水溶液導電的原因是一水合氨、碳酸電離出的離子,不是NH3、CO2本身電離的離子,因此NH3、CO2屬于非電解質,故B錯誤;
C、25g CuSO45H2O的物質的量為 ![]() =0.1mol,故n(CuSO4)=0.1mol,溶液體積為100mL,故該溶液中CuSO4的物質的量濃度為:
=0.1mol,故n(CuSO4)=0.1mol,溶液體積為100mL,故該溶液中CuSO4的物質的量濃度為: ![]() =1mol/L,故C正確;
=1mol/L,故C正確;
D、沒有950ml的容量瓶,應選擇1000ml容量瓶,配制0.2mol/L的NaCl溶液需氯化鈉質量為1L×0.2mol/L×58.5g/mol=11.7g,故D錯誤,故選C.
【考點精析】解答此題的關鍵在于理解配制一定物質的量濃度的溶液的相關知識,掌握配制物質的量濃度溶液時,先用燒杯加蒸餾水至容量瓶刻度線1cm~2cm后,再改用交投滴管加水至刻度線.


 教材全解字詞句篇系列答案
教材全解字詞句篇系列答案科目:高中化學 來源: 題型:
【題目】工業上制取氯酸鉀的主要步驟為:
I.將Cl2通入石灰漿,在75℃左右充分反應,然后過濾;
II.向濾液中加入稍過量的KCl固體,進行適當操作可析出KClO3固體。
請回答下列問題:
(1)步驟I中總反應的化學方程式為6Ca(OH)2+ 6Cl2=Ca(ClO3)2+5CaCl2+ 6H2O 。
①標出反應中電子轉移的方向和數目______________。
②濾液中Ca(ClO3)2與CaC12的物質的量之比n[Ca(ClO3)2]:n [CaCl2]____l∶5 (填“> ”“< ”、或“=” ) ,理由是___________。
(2)下圖是有關物質的溶解度曲線。步驟II中,若溶液中KClO3的含量為147g·L-1,則KClO3得物質的量濃度為_______________。從該溶液中盡可能多地析出KClO3 固體的方法是______________。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】雙酚A的結構簡式如下圖所示,下列有關此物質的說法正確的是( )

A. 1 mol該物質與足量溴水反應消耗2 mol Br2
B. 該物質能與碳酸氫鈉溶液反應放出CO2
C. 該物質的所有碳原子可能在同一平面
D. 該物質與足量氫氣發生加成反應后所得物質的化學式為C15H28O2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溶液中可能含有Na+、NH4+、Cl﹣、SO42﹣、NO3﹣、CO32﹣ , 現進行如下實驗:
(I)取一定量的溶液于試管中,加入過量的Ba(NO3)2溶液有白色沉淀生成,過濾出的沉淀部分溶于稀HNO3 , 并放出5.6L(標況下)無色無味的氣體,剩余沉淀4.66g.
(II)取部分濾液,加入過量的NaOH溶液并加熱,產生13.6g無色有刺激性氣味的氣體,該氣體能使濕潤的紅色石蕊試紙變藍.
(III)另取部分濾液,加入AgNO3溶液,無明顯現象.
根據以上現象,試判斷:
①溶液中肯定存在的離子是 ;
②溶液中肯定不存在的離子是 ;
③溶液中可能存在的離子是 ;
④寫出實驗(I)中沉淀部分溶于稀HNO3并放出無色無味氣體的離子方程式:
⑤實驗(II)中產生氣體的離子方程式為 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將4 g NaOH溶解于水配成1L溶液,從中取出10mL,這10mL溶液的物質的量濃度是( )
A.1 mol/L
B.0.1 mol/L
C.0.01 mol/L
D.10 mol/L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關金屬腐蝕的敘述正確的是
A. 金屬越純越不易被腐蝕 B. 干燥環境下金屬不被腐蝕
C. 銅一定比鐵難腐蝕 D. 金屬的腐蝕有化學腐蝕和電化學腐蝕
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為了保護環境,充分利用資源,某研究小組通過如下簡化流程,將工業制硫酸的硫鐵礦燒渣(鐵主要以![]() 存在)轉變成重要的工業原料
存在)轉變成重要的工業原料![]() (反應條件略)
(反應條件略)
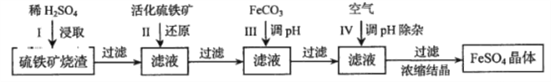
活化硫鐵礦還原Fe2+的主要反應為:FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4,不考慮其他反應,請回答下列問題:
(1)第Ⅰ步H2SO4與Fe2O3反應的離子方程式是___________________________。
(2)檢驗第Ⅱ步中Fe3+是否完全還原,應選擇(________)(填字母編號)。
A.KMnO4溶液 B.淀粉-KI溶液 C.KSCN溶液
(3)第Ⅲ步加FeCO3調溶液pH到5.8左右,然后再第VI步通入空氣使溶液pH降到5.2,此時Fe2+不沉淀,濾液中鋁、硅雜質除盡。通入空氣引起溶液pH降低的原因是________________。
(4)FeSO4可轉化為FeCO3,FeCO3在空氣中加熱反應可制得鐵系氧化物材料。
已知25℃,101kPa時:
4Fe(s)+3O2(g)=2Fe2O3(s) ΔH=-1648kJ/mol
C(s)+O2(g)=CO2(g) ΔH=-393kJ/mol
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s) ΔH=-1480kJ/mol
FeCO3在空氣中加熱反應生成Fe2O3的熱化學方程式是______________。
(5)FeSO4在一定條件下可制得FeS2(二硫化亞鐵)納米材料。該材料可用于制造高容量鋰電池,電池放電時的總反應為4Li+FeS2=Fe+2Li2S,正極反應式是________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏加德羅常數的值,下列說法中正確的是
A. 1 mol FeI2與足量氯氣反應時轉移的電子數為2NA
B. 常溫常壓下,46gNO2和N2O4混合氣體含有的原子數為3NA
C. 在過氧化鈉與水的反應中,每生成0.1mol氧氣,轉移電子數為0.4 NA
D. 常溫下56 g鐵片投入足量濃H2SO4中生成NA個SO2分子
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com