

分析 (1)根據圖1裝置可知,二氧化硫密度大于空氣,所以收集二氧化硫時應長時短出,B中發生反應為亞硫酸鈉和濃硫酸反應生成二氧化硫、硫酸鈉和水,二氧化硫會污染空氣,所以要進行尾氣吸收;
(2)二氧化硫通入硫化鈉溶液發生氧化還原反應生成淡黃色沉淀硫單質,說明二氧化硫具有氧化性,氧化硫離子生成硫單質,足量二氧化硫和硫化鈉溶液反應得到硫單質和亞硫酸氫鈉;
(3)過量的二氧化硫能溶于水,也能使高錳酸鉀褪色,據此判斷;
(4)實驗室可通過Na2S、Na2CO3和SO2共同反應生成二氧化碳和Na2S2O3;
解答 解:(1)根據圖1裝置可知,二氧化硫密度大于空氣,所以收集二氧化硫時應長時短出,所以C處有錯,裝置B中發生的反應為亞硫酸鈉和濃硫酸反應生成二氧化硫、硫酸鈉和水,反應的化學方程式為:Na2SO3+H2SO4=Na2SO4+H2O+SO2↑;二氧化硫會污染空氣,所以D的作用是進行尾氣吸收,
故答案為:集氣瓶C中導管長短反了;Na2SO3+H2SO4=Na2SO4+H2O+SO2↑;吸收尾氣中的SO2,防止污染環境
(2)二氧化硫通入硫化鈉溶液發生氧化還原反應生成淡黃色沉淀硫單質,硫元素化合價+4價變化為0價,說明二氧化硫具有氧化性,氧化硫離子生成硫單質,足量二氧化硫和硫化鈉溶液反應得到硫單質和亞硫酸氫鈉,反應的離子方程式為:2S2-+5SO2+2H2O=3S↓+4HSO3-,
故答案為:有淺黃色沉淀生成,氧化,2S2-+5SO2+2H2O=3S↓+4HSO3-;
(3)過量的二氧化硫能溶于水,也能使高錳酸鉀褪色,所以方案一不合理,反應的離子方程式為:5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+,
故答案為:方案一;過量的二氧化硫能溶于水,也能使高錳酸鉀褪色; 5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+;
(4)實驗室可通過Na2S、Na2CO3和SO2共同反應生成二氧化碳和Na2S2O3,反應的化學方程式為:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2 ,
故答案為:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2 ;
點評 本題考查了探究物質的組成、測量物質的含量的方法,題目難度中等,試題涉及了二氧化硫性質、中和滴定的計算,要求學生掌握探究物質組成、測量物質含量的方法,明確二氧化硫的化學性質及中和滴定的操作方法及計算方法,試題培養了學生靈活應用所學知識的能力.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
 一種熔融碳酸鹽燃料電池原理示意如圖.下列有關該電池的說法正確的是( )
一種熔融碳酸鹽燃料電池原理示意如圖.下列有關該電池的說法正確的是( )| A. | 如用此種電池電鍍銅,待鍍銅金屬上增重19.2g,則至少消耗標準狀況下2.24L CH4 | |
| B. | 電極A上H2參與的電極反應為:H2+2OH--2e-=2H2O | |
| C. | 電池工作時,CO32-向電極B移動 | |
| D. | 電極B上發生的電極反應為:O2+2CO2+4e-=2CO32- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 含SO2的煙氣若不經過海水脫硫直接排放可造成酸性降雨 | |
| B. | “氧化”是利用氧氣將H2SO3、HSO3-、SO32-等氧化生成SO42- | |
| C. | “反應、稀釋”時加天然海水的目的是中和、稀釋經氧化后海水中生成的酸 | |
| D. | “排放”出來的海水中SO42-的物質的量濃度與進入吸收塔的天然海水相同 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 下圖是鹽酸與氫氧化鈉溶液的滴定曲線a和b.
下圖是鹽酸與氫氧化鈉溶液的滴定曲線a和b.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
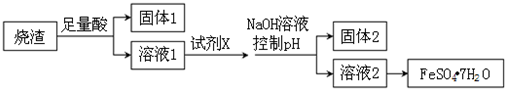
| A. | 溶解燒渣選用足量硫酸,試劑X選用鐵粉 | |
| B. | 固體1中一定含有SiO2,控制pH是為了使Al3+轉化為Al(OH)3,進入固體2 | |
| C. | 若改變方案,在溶液1中直接加NaOH至過量,得到的沉淀用硫酸溶解,其溶液經結晶分離也可得到FeSO4•7H2O | |
| D. | 從溶液2得到FeSO4•7H2O產品的過程中,須控制條件防止其氧化和分解 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com