
| A. | a=b時,c(H2C2O4)+c(H+)=c(C2O42-)+c(OH-) | |
| B. | a=$\frac{b}{2}$時,c(C2O42-)>c(HC2O4-)>c(H2C2O4)>c(OH-) | |
| C. | a=2b時,2c(Na+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-) | |
| D. | a=3b時,c(Na+)+c(H+)=c(HC2O4-)+c(C2O42-)+c(OH-) |
分析 NaHC2O4溶液顯酸性,說明HC2O4-電離程度大于HC2O4-水解程度,
A.a=b時,二者恰好反應生成NaHC2O4,結合電荷守恒和物流守恒判斷;
B.a=$\frac{b}{2}$時,二者恰好反應生成Na2C2O4,溶液中存在C2O42-和HC2O4-的兩種離子的水解;
C.a=2b時,H2C2O4過量,結合物料守恒判斷;
D.a=3b時,H2C2O4過量,結合電荷守恒判斷.
解答 解:NaHC2O4溶液顯酸性,說明HC2O4-電離程度大于HC2O4-水解程度,
A.a=b時,二者恰好反應生成NaHC2O4,溶液存在電荷守恒,為c(Na+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-),存在物料守恒,為c(Na+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-),二者聯式可得c(H2C2O4)+c(H+)=c(C2O42-)+c(OH-),故A正確;
B.a=$\frac{b}{2}$時,二者恰好反應生成Na2C2O4,溶液中存在C2O42-和HC2O4-的兩種離子的水解,則c(OH-)>c(H2C2O4),故B錯誤;
C.a=2b時,H2C2O4過量,反應后溶液中存在H2C2O4、HC2O4-、C2O42-,其物質的量之和為Na+的2倍,則2c(Na+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-),故C正確;
D.a=3b時,H2C2O4過量,溶液存在電荷守恒,為c(Na+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-),故D錯誤.
故選AC.
點評 本題考查離子濃度大小的比較,為高考常見題型和高頻考點,側重于學生的分析能力的考查,注意把握鹽類水解與弱電解質的電離特點和影響因素,結合電荷守恒、物料守恒解答該題,難度中等.


 開心快樂假期作業暑假作業西安出版社系列答案
開心快樂假期作業暑假作業西安出版社系列答案 名題訓練系列答案
名題訓練系列答案科目:高中化學 來源: 題型:選擇題
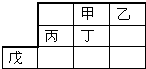
| A. | 最高價氧化物水化物的酸性:乙>丁 | |
| B. | 甲的一種單質是自然界最硬的物質 | |
| C. | 戊元素位于第4周期第 VⅢ族 | |
| D. | 乙、丙的最高價氧化物的水化物可以反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Ba2+對人體無害,可用BaSO4做鋇餐造影劑 | |
| B. | 海水提鎂和海水提溴都涉及氧化還原反應 | |
| C. | 大量燃燒含硫的化石燃料是形成酸雨的主要原因 | |
| D. | 航天飛機上的陶瓷防護片屬于新型無機非金屬材料 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
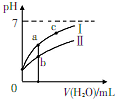 已知下表為250C時某些弱酸的電離平衡常數.如圖表示常溫時,稀釋CH3COOH.HC1O兩種酸的稀溶液時,溶液pH隨加水量的變化.依據所給信息,下列說法正確的是( )
已知下表為250C時某些弱酸的電離平衡常數.如圖表示常溫時,稀釋CH3COOH.HC1O兩種酸的稀溶液時,溶液pH隨加水量的變化.依據所給信息,下列說法正確的是( )| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
| A. | 向NaCl0溶液中通人少量二氧化碳的離子方程式為:2C1O-+CO2+H2O=2HClO+CO32- | |
| B. | 相同濃度的CH3COONa和NaClO的混合溶液中,各離子濃度的大小關系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| C. | a、b、c三點所示溶液中水的電離程度:c>a>b | |
| D. | 圖象中,I表示CH3COOH,Ⅱ表示HC1O,且溶液導電性:c>b>a |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .合成M的一種途徑如下:
.合成M的一種途徑如下: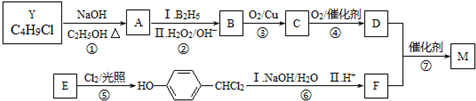
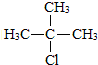 .
. .
.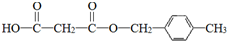 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 生活中鋼鐵制品生銹主要是由于吸氧腐蝕所致 | |
| B. | 冰箱中使用的含氟制冷劑泄漏后,會增加空氣中PM 2.5的含量 | |
| C. | 氯氣和活性炭均可作為漂白劑,同時使用可增強漂白效果 | |
| D. | 明礬[KAl(SO4)2•12H2O]溶于水會形成膠體,因此可用于自來水的殺菌消毒 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 足量鐵在氯氣中反應,1mol鐵失去的電子數為2NA | |
| B. | 標準狀況下22.4LH2中含中子數為2NA | |
| C. | NaBH4是一種重要的儲氫載體,1molNaBH4與水反應[NaBH4+2H2O=NaBO2+4H2↑]時轉移的電子數目為8NA | |
| D. | 常溫下,1L0.2mol/L的鹽酸溶液通人氨氣當溶液pH=7,則溶液中NH4+數為0.2NA |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com