
分析 (1)mol/L的NaOH溶液意義為1L溶液中含有溶質的物質的量為2mol,質量為80g;
則配制濃度約為2 mol/L的NaOH溶液100 ml,需要溶質的質量為2mol/L×0.1L×40g/mol=8.0g,注意物質的量濃度中體積為溶液的體積不是容積的體積;
(2)A.強電解質是熔融態或水溶液中完全電離的化合物,常見強電解質為強酸、強堿、大多數鹽;
B.既能與酸反應,又能與堿反應的物質有弱酸弱堿鹽、弱酸的酸式鹽、兩性氧化物、兩性氫氧化物、金屬鋁、蛋白質和氨基酸等物質;
C.本題考查有關膠體的性質,將三氯化鐵溶液滴入沸水加熱可得紅褐色液體,形成氫氧化鐵膠體,膠體具有丁達爾效應、電泳現象,結合氫氧化鐵性質解答;
解答 解;(1)①稱取8gNaOH固體,放入250ml燒杯中,用100ml量筒量取100ml蒸餾水,溶質的物質的量為0.2mol,溶液體積為0.1L,所配溶液濃度為2mol/L,故正確;
②固體不能在容量瓶中溶解,故錯誤;
③容量瓶為精密儀器,不能用來溶解固體,故錯誤;
④用100ml量筒量取40ml5mol/LNaOH溶液,倒入250ml燒杯中,再用同一量筒取60ml蒸餾水,不斷攪拌下,慢慢倒入燒杯中,依據溶液稀釋規律:40ml×5mol/L=100mL×c,解得C=2mol/L,故正確;
故選:①④;
(2)(A)①NH4Cl、②NaOH、③FeCl3、④NaHCO3、在水溶液中都能完全電離屬于強電解質;
⑤Al是單質,不是電解質;⑥CH3COOH、⑧H2CO3只能部分電離,屬于弱電解質;⑦鹽酸是混合物不是電解質;
所以屬于強電解質的是:①②③④;
故答案為:①②③④;
(B)①NH4Cl不能與鹽酸反應,故不選;
②NaOH不能與堿反應,故不選;
③FeCl3不能與鹽酸反應,故不選;
④NaHCO3,是弱酸的酸式鹽,既能與鹽酸又能與氫氧化鈉反應,故選;
⑤Al與鹽酸反應生成氯化鋁和氫氣,與氫氧化鈉溶液反應生成偏鋁酸鈉鈉溶液和水,故選;
⑥CH3COOH與鹽酸不反應,故不選;
⑦鹽酸與鹽酸不反應,故不選;
⑧H2CO3與鹽酸不反應,故不選;
故選:④⑤;
(C)將三氯化鐵溶液滴入沸水加熱可得紅褐色液體,形成氫氧化鐵膠體.
A.體現膠體的丁達爾效應,故A正確;
B.氫氧化鐵膠粒帶電,有電泳現象,故B正確;
C.三氯化鐵水解生成氫氧化鐵膠體,同時還有鹽酸生成在溶液里,與硝酸銀生成沉淀,故C錯誤;
D.氫氧化鐵膠體加熱出現氫氧化鐵沉淀,繼續加熱失水生成三氧化二鐵,故D正確;
故選:C.
點評 本題為綜合題考查了一定物質的量濃度溶液的配制、強電解質的判斷、膠體的性質、既與鹽酸反應又與氫氧化鈉反應物質判斷,明確配制原理、強電解質的性質、相關物質的性質是解題關鍵,題目難度不大.


科目:高中化學 來源: 題型:選擇題

| A. | Al2O3、SiCl4均為共價化合物 | |
| B. | 生產過程中均涉及氧化還原反應 | |
| C. | 石英可用于制光導纖維,晶體Si常用做半導體材料 | |
| D. | 黃銅礦冶煉銅時產生的SO2可用于生產硫酸,FeO可用于冶煉鐵 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
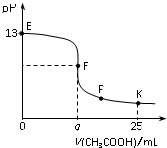 25℃時,在25 mL 0.1 mol/L的NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,混合溶液pH的變化曲線如圖所示,下列分析結論正確的是( )
25℃時,在25 mL 0.1 mol/L的NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,混合溶液pH的變化曲線如圖所示,下列分析結論正確的是( )| A. | a=12.5,且混合溶液pH=7 | |
| B. | 對應曲線上E、F之間的任何一點,溶液中都有c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| C. | P點時,c(CH3COO-)>c(Na+)>c(H+)=c(OH-) | |
| D. | K點時,c(CH3COO-)+c(CH3COOH)=2c(Na+) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
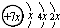 ,B是同周期第一電離能最小的元素,C的最外層有三個成單電子,E的外圍電子排布式為3d64s2.回答下列問題:
,B是同周期第一電離能最小的元素,C的最外層有三個成單電子,E的外圍電子排布式為3d64s2.回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 自然界中,不存在鎂單質,碳元素多種單質 | |
| B. | CO可以還原氧化銅,Mg能還原CO2,反應類型均為置換反應 | |
| C. | 電解熔融氯化鎂可制備Mg單質和氯氣,海水提取海鹽后的鹵水可用于提取氯化鎂 | |
| D. | 煤與水蒸氣高溫反應生成水煤氣,其主要成分是CO和H2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
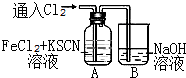 甲學生對Cl2與FeCl2和KSCN混合溶液的反應進行實驗探究.向A中通入氯氣至過量,發現A中溶液先呈紅色后逐漸變為黃色.
甲學生對Cl2與FeCl2和KSCN混合溶液的反應進行實驗探究.向A中通入氯氣至過量,發現A中溶液先呈紅色后逐漸變為黃色.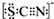 .則碳元素的化合價是+4
.則碳元素的化合價是+4查看答案和解析>>
科目:高中化學 來源: 題型:填空題
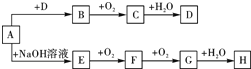 A~H等8種物質存在如下轉化關系(反應條件,部分產物未標出).已知:A是正鹽,B是能使品紅溶液褪色的氣體,G是紅棕色氣體.按要求回答問題:
A~H等8種物質存在如下轉化關系(反應條件,部分產物未標出).已知:A是正鹽,B是能使品紅溶液褪色的氣體,G是紅棕色氣體.按要求回答問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com