
分析 (1)Ni是28號元素,根據能量最低原則、泡利不相容原理和洪特規則,寫出其核外電子排布式為:1s22s22p43s23p43d84s2,據此判斷其所在位置;
(2)依據電池反應分析,充電為電解池,放電為原電池;放電過程中原電池的負極上失電子發生氧化反應,正極上發生還原反應;
(3)放電時正極發生還原反應,正極反應式為:NiO2+2e-+2H2O=Ni(OH)2+2OH-,充電時該電極發生氧化反應,是該電極反應的逆反應;
(4)電解NaCl溶液,且電解池的電極均為惰性電極,陰極生成氫氣,電極方程式為2H++2e-=H2↑,陽極生成氯氣,電極方程式為2Cl--2e-=Cl2↑,根據電子守恒計算;
(5)①逐滴加入NaOH溶液,剛開始沉淀時需要的c(OH-)越小越先沉淀,根據溶度積常數計算;
②根據溶度積常數計算.
解答 解:(1)Ni是28號元素,其核外電子排布式為:1s22s22p43s23p43d84s2,位于元素周期表第10列,其在元素周期表位置為:第四周期第Ⅷ族;
故答案為:第四周期第Ⅷ族;
(2)根據原電池在放電時,負極發生氧化反應,正極發生還原反應,再根據元素化合價變化,可判斷該電池負極發生反應的物質為Fe被氧化發生氧化反應,正極為NiO2,被還原發生還原反應,此電池為堿性電池,在書寫電極反應和總電池反應方程式時不能出現H+,故放電時的電極反應是:負極:Fe-2e-+2OH-=Fe(OH)2,正極:NiO2+2e-+2H2O=Ni(OH)2+2OH-,所以該電池發生氧化反應的物質是Fe;
故答案為:A;
(3)放電時正極發生還原反應,正極反應式為:NiO2+2e-+2H2O=Ni(OH)2+2OH-,充電時該電極發生氧化反應,是該電極反應的逆反應,電極反應式為:Ni(OH)2+2OH--2e-=NiO2+2H2O,
故答案為:Ni(OH)2+2OH--2e-=NiO2+2H2O;
(4)電解NaCl溶液,且電解池的電極均為惰性電極,陰極生成氫氣,電極方程式為2H++2e-=H2↑,陽極生成氯氣,電極方程式為2Cl--2e-=Cl2↑,電路中轉移了0.1mol e-,可知生成0.05molCl2,體積為0.05mol×22.4L/mol=1.12L,電解后c(OH-)=$\frac{0.1mol}{1L}$=0.1mol/L,則c(H+)=1×10-13,溶液的pH=13,
故答案為:1.12L;13;
(5)①逐滴加入NaOH溶液,剛開始沉淀時需要的c(OH-)越小越先沉淀,根據溶度積常數,Fe3+開始沉淀時需要的c(OH-)=$\root{3}{\frac{1×1{0}^{-38}}{0.1}}$=$\root{3}{0.1}$×10-12mol/L,Ni2+開始沉淀時需要的c(OH-)=$\sqrt{\frac{1.0×1{0}^{-15}}{0.1}}$=10-7mol/L,Fe3+開始沉淀時需要的c(OH-)比Ni2+開始沉淀時需要的c(OH-)小,則Fe3+先沉淀,
故答案為:Fe3+;
②,Fe3+沉淀完全c(Fe3+)約為10-5mol/L,則Fe3+沉淀完全c(OH-)應大于$\root{3}{\frac{1×1{0}^{-38}}{1{0}^{-5}}}$=1×10-11mol/L,c(H+)=1×10-3mol/L,溶液的pH>3,Ni2+開始沉淀時需要的c(OH-)=$\sqrt{\frac{1.0×1{0}^{-15}}{0.1}}$=10-7mol/L,c(H+)=$\frac{1×1{0}^{-14}}{1{0}^{-7}}$=10-7mol/L,Ni2+不沉淀,溶液的pH還必須小于7,則要想使Fe3+沉淀完全,Ni2+不沉淀,溶液的pH需控制的范圍是3<pH<7,
故答案為:3<pH<7.
點評 本題以蓄電池為載體考查了化學電源新型電池、原電池的工作原理、溶度積常數的計算,注意把握判斷該電池的正負極及電極反應式.要學會從教材中找出知識點原型進行知識遷移、解決問題的方法,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 24 | B. | 42 | C. | 66 | D. | 108 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在AlCl3溶液中:Na+、NH4+、S2O32-、SO42- | |
| B. | 使pH試紙變藍色的溶液中:Cu2+、NO3-、Fe3+、SO42- | |
| C. | 與鋁粉反應放出氫氣的無色溶液中:Na+、Al3+、SO42-、NO3- | |
| D. | 常溫下$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液中:K+、AlO2-、Na+、CO32- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
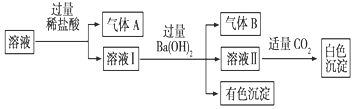 某水溶液中可能存在Na+、Al3+、Fe2+、NH4+、NO3-、CO32-、SO42-中的若干種離子,且存在的各離子具有相同的物質的量,某同學對該溶液進行如圖實驗,下列判斷正確的是( )
某水溶液中可能存在Na+、Al3+、Fe2+、NH4+、NO3-、CO32-、SO42-中的若干種離子,且存在的各離子具有相同的物質的量,某同學對該溶液進行如圖實驗,下列判斷正確的是( )| A. | 氣體A一定是CO2,氣體B一定是NH3 | |
| B. | 白色沉淀一定是Al(OH)3 | |
| C. | 溶液中一定存在Fe2+、NO3-、NH4+、SO42- | |
| D. | 溶液中可能存在Na+ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NaOH、FeSO4在空氣中放置變質 | B. | 氯水、AgI密封保存在棕色試劑瓶中 | ||
| C. | 乙烯使溴水和酸性KMnO4溶液褪色 | D. | 常溫下濃硝酸不能溶解Al和Au(金) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 操作 | 現象 | 結論 |
| A | 將碳酸氫鈉分解產生的氣體通入CaCl2溶液 | 產生白色沉淀 | CO2與CaCl2溶液反應 |
| B | 常溫下將Al片放入濃硝酸中 | 無明顯現象 | Al與濃硝酸不反應 |
| C | 將水蒸氣通過灼熱的鐵粉 | 有黑色晶體生成 | 鐵與水在高溫下發生反應 |
| D | 將0.1mol•L-1MgSO4溶液滴入NaOH溶液至不在有沉淀產生,再滴加0.1mol•L-1CuSO4溶液 | 先有白色沉淀生成后變為淺色藍色沉淀 | Mg(OH)2的溶度積(Ksp)比Cu(OH)2小 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 編號 | 容器 | 起始時物質的量 mol | 平衡時物質的量/mol | 平衡常數(K) | |
| Fe2O3 | CO | Fe | |||
| 1 | 恒溫 | 0.5 | 1.5 | 0.8 | K1 |
| 2 | 恒溫 | 2 | 3 | m | K2 |
| 3 | 絕熱 | 1 | 1.5 | n | K3 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com