
分析 (1)設H2和O2物質的量分別為amol、bmol,根據m=nM計算質量,再根據$\overline{M}$=$\frac{{m}_{總}}{{n}_{總}}$計算平均相對分子質量;
設H2和O2質量分別為ag、bg,根據n=$\frac{m}{M}$計算物質的量,再根據M$\overline{M}$=$\frac{{m}_{總}}{{n}_{總}}$計算平均相對分子質量;
(2)10mLA受熱分解生成15mLO2和10mLF2,根據氣體的體積之比等于物質的量之比,則方程式中A、O2、F2的物質的量之比是10:15:10=2:3:2,即該反應的化學方程式為2A=3O2+2F2,根據質量守恒定律得A的化學式.
解答 解:(1)設H2和O2物質的量分別為amol、bmol,根據$\overline{M}$=$\frac{{m}_{總}}{{n}_{總}}$可知平均相對分子質量為$\frac{2a+32b}{a+b}$;
設H2和O2質量分別為ag、bg,物質的量之比為$\frac{a}{2}$:$\frac{b}{32}$=16a:b,根據M$\overline{M}$=$\frac{{m}_{總}}{{n}_{總}}$可知平均相對分子質量$\frac{16a×2+b×32}{16a+b}$=$\frac{32(a+b)}{16a+b}$,
故答案為:$\frac{2a+32b}{a+b}$;$\frac{32(a+b)}{16a+b}$;
(2)10mLA受熱分解生成15mLO2和10mLF2,根據氣體的體積之比等于物質的量之比,則方程式中A、O2、F2的物質的量之比是10:15:10=2:3:2,即該反應的化學方程式為2A=3O2+2F2,根據質量守恒定律得A的化學式為O3F2,推斷的依據是阿伏伽德羅定律和質量守恒定律,
故答案為:O3F2;阿伏伽德羅定律和質量守恒定律.
點評 本題考查阿伏伽德羅定律、質量守恒定律的應用、物質的量有關計算,難度不大,注意對基礎知識的理解掌握.


 小學教材全測系列答案
小學教材全測系列答案 小學數學口算題卡脫口而出系列答案
小學數學口算題卡脫口而出系列答案 優秀生應用題卡口算天天練系列答案
優秀生應用題卡口算天天練系列答案科目:高中化學 來源: 題型:解答題
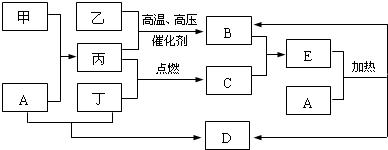
 ;
;查看答案和解析>>
科目:高中化學 來源: 題型:解答題
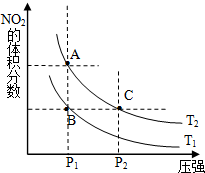 (1)對反應N2O4(g)═2NO2(g)△H>0,在溫度為T1、T2時,平衡體系中NO2的體積分數隨壓強變化曲線如圖所示.T1<T2(填“>”、“<”或“=”);A、C兩點的速率VA<VC(同上).
(1)對反應N2O4(g)═2NO2(g)△H>0,在溫度為T1、T2時,平衡體系中NO2的體積分數隨壓強變化曲線如圖所示.T1<T2(填“>”、“<”或“=”);A、C兩點的速率VA<VC(同上).| 時間(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 次氯酸電子式 | B. | 核內有8個中子的碳原子${\;}_{6}^{8}$C | ||
| C. | CO2的比例模型 | D. | 純堿的化學式Na2CO3 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
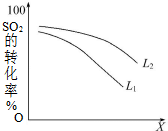 一定溫度下,在2L密閉容器中發生反應:2SO2(g)+O2(g)?2SO3(g)△H=-196kJ•mol-1
一定溫度下,在2L密閉容器中發生反應:2SO2(g)+O2(g)?2SO3(g)△H=-196kJ•mol-1查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | n(Cl2):n(Fe)=5:4 5Cl2+4Fe $\frac{\underline{\;點燃\;}}{\;}$2FeCl2+2FeCl3 | |
| B. | n(Cl2):n(FeBr2)=1:1 Fe2++2Br-+Cl2═Fe3++Br2+2Cl- | |
| C. | n(MnO4-):n(H2O2)=2:3 2MnO4-+3H2O2+6H+═2Mn2++4O2↑+6H2O | |
| D. | n(Fe):n[HNO3(稀)]=1:3 4Fe+12H++3NO3-═3Fe2++Fe3++3NO↑+6H2O |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com