
分析 反應生成Cl2在標準狀況下體積為56L,根據n=$\frac{V}{{V}_{m}}$計算物質的量,再根據方程式計算HCl,結合元素化合價的變化分析.
解答 解:(1)反應生成Cl2在標準狀況下體積為56L,則氯氣的物質的量為n=$\frac{V}{{V}_{m}}$=$\frac{56L}{22.4L/mol}$=2.5mol,則參加反應的HCl的物質的量為2.5mol×$\frac{16}{5}$=8mol;
答:參加反應的HCl的物質的量為8mol;
(2)反應中16molHCl只有8mol被氧化,即被氧化的HCl占總的HCl物質的量$\frac{1}{2}$,所以反應中被氧化的HCl的物質的量為4mol;
答:反應中被氧化的HCl的物質的量為4mol;
(3)2KMnO4+16HCl═2MnCl2+5Cl2↑+8H2O+2KCl中,Mn元素的化合價降低,Cl元素的化合價升高,該反應轉移10e-,雙線橋標出電子的轉移方向和數目為 ,
,
答:并用雙線橋標出電子轉移的方向和數目 .
.
點評 本題考查物質的量的計算、化學方程式計算、氧化還原反應,題目難度不大,注意對基礎知識的理解掌握,明確元素化合價的變化以及反應中各物質之間的關系是解題的關鍵.


科目:高中化學 來源: 題型:解答題
| 物質 | CH3OH | CH3OCH3 | H2O |
| c(mol•L-1) | 0.46 | 1.0 | 1.0 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2HgO$\frac{\underline{\;\;△\;\;}}{\;}$2Hg+O2↑ | B. | Fe3O4+4CO$\frac{\underline{\;高溫\;}}{\;}$3Fe+4CO2↑ | ||
| C. | Fe+CuSO4═FeSO4+Cu | D. | 2NaCl(熔融)$\frac{\underline{\;通電\;}}{\;}$2Na+Cl2↑ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向某無色溶液中加入BaCl2溶液有白色沉淀出現,再加入稀鹽酸,沉淀不消失,則該溶液中一定含有SO42- | |
| B. | 焰色反應試驗中,透過藍色鈷玻璃,可觀察到Na+離子火焰呈黃色 | |
| C. | 檢驗Na2CO3固體中是否混有NaHCO3,可向固體滴加稀鹽酸,觀察是否產生體 | |
| D. | 用丁達爾效應可鑒別FeCl3溶液和Fe(OH)3膠體 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 )的過程中,欲使原子利用率達到最高,還需要其他的反應物是( )
)的過程中,欲使原子利用率達到最高,還需要其他的反應物是( )| A. | CO和CH3OH | B. | CO2和H2O | C. | H2和CO2 | D. | CH3OH和H2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
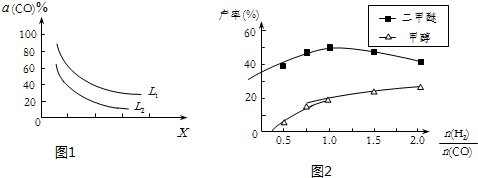
| A. | 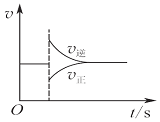 圖可以表示對某化學平衡體系改變溫度后反應速率隨時間的變化 | |
| B. | 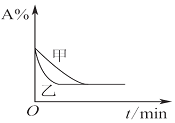 圖表示壓強對可逆反應2A(g)+2B(g)?3C(g)+D(g)的影響,且甲的壓強大 | |
| C. | 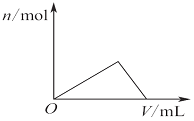 圖表示向Al2(SO4)3和MgSO4的混合液中滴加NaOH溶液,生成沉淀的量與滴入NaOH溶液體積的關系 | |
| D. | 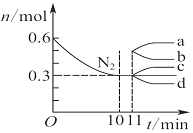 圖表示在2 L的密閉容器中發生合成氨反應時N2的物質的量隨時間的變化曲線,0~10 min內該反應的平均速率v(H2)=0.045 mol•L-1•min-1,從11 min起其他條件不變,壓縮容器的體積為1 L,則n(N2)的變化曲線為d |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 存在的電離平衡為:HCO3-+H2O?H2CO3+OH- | |
| B. | c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) | |
| C. | c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) | |
| D. | HCO3-的電離程度大于HCO3-的水解程度 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com