
(13分)(1)常溫下,0.05mol/L硫酸溶液中,c(H+)= mol/L,pH值為 ,水電離的c(H+)= mol/L。如圖所示,一定溫度下,冰醋酸加水稀釋過程中溶液的導電能力曲線圖,請回答。

(2)“O”點為什么不導電 。
(3)a、b、c三點的氫離子濃度由小到大的順序為 。
(4)a、b、c三點中,醋酸的電離程度最大的一點是 。
(5)若使c點溶液中的c(CH3COO-)提高,在如下措施中,可選擇 。
A.加NaCl溶液 B.加熱
C.加固體KOH D.加Zn粒
E.加固體CH3COONa F.加水
(6)在稀釋過程中,隨著醋酸濃度的降低,下列始終保持增大趨勢的量是__________________。
A.H+個數 B.c(H+)
C.c(H+)/c(CH3COOH) D.CH3COOH分子數
(1)0.1 mol/L 1 10-13 mol/L (2)因為冰醋酸未電離,無自由移動的離子
(3)c<a<b (4)c (5)B、C、D、E (6)A、C
【解析】
試題分析:(1)0.05mol/L硫酸溶液中c(H+)=0.1 mol/L,pH值為1,水電離的c(H+)為10-13 mol/L。
(2)在O點醋酸沒有電離,只有醋酸分子,無自由移動的離子,所以不能導電。
(3)氫離子濃度越大,導電能力越強,所以根據圖像可知氫離子濃度的大小順序為b>a>c。
(4)醋酸是弱酸,存在電離平衡,稀釋促進電離,所以c點醋酸的電離程度最大。
(5)根據CH3COOH CH3COO-+H+,加NaCl溶液,平衡不移動c(CH3COO-)不變,加熱平衡正向移動,c(CH3COO-)增大,加固體KOH,平衡正向移動,c(CH3COO-)增大,加Zn粒,平衡正向移動,c(CH3COO-)增大,加固體CH3COONa,平衡逆向移動,但c(CH3COO-)增大,加水平衡正向移動,但c(CH3COO-)減小。所以能使c(CH3COO-)增大的措施是BCDE。
CH3COO-+H+,加NaCl溶液,平衡不移動c(CH3COO-)不變,加熱平衡正向移動,c(CH3COO-)增大,加固體KOH,平衡正向移動,c(CH3COO-)增大,加Zn粒,平衡正向移動,c(CH3COO-)增大,加固體CH3COONa,平衡逆向移動,但c(CH3COO-)增大,加水平衡正向移動,但c(CH3COO-)減小。所以能使c(CH3COO-)增大的措施是BCDE。
(6)根據CH3COOH CH3COO-+H+,稀釋過程中平衡正向移動,H+個數增加,c(H+)減小,c(CH3COO-)減小,CH3COOH分子數減小,根據K=
CH3COO-+H+,稀釋過程中平衡正向移動,H+個數增加,c(H+)減小,c(CH3COO-)減小,CH3COOH分子數減小,根據K=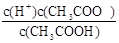 ,c(CH3COO-)減小,所以
,c(CH3COO-)減小,所以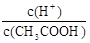 增大。因此選AC。
增大。因此選AC。
考點:電離平衡
點評:本題綜合性較強,難度較大,主要要運用好平衡常數。


科目:高中化學 來源: 題型:閱讀理解
| ||
| ||
| 實驗編號 | 氨水物質的量濃度 (mol?L-1) |
鹽酸物質的量濃度 (mol?L-1) |
混合溶液pH |
| ① | 0.1 | 0.1 | pH=5 |
| ② | C | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH>7 |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
 2CA3(g)
2CA3(g)| 1.00 |
| 0.9 |
| c2(NH3) |
| c(N2)×c3(H2) |
(
| ||||
(
|
| 1.00 |
| 0.9 |
| c2(NH3) |
| c(N2)×c3(H2) |
(
| ||||
(
|
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
(9分)(1)常溫下,有0.1mol/L的氨水和0.1mol/L的氫氧化鈉溶液,回答下列問題:
①pH 值:氨水 氫氧化鈉(填“<” 、“=” 或 “>”)
②兩種堿溶液均能與鹽酸反應生成鹽,等體積的上述兩溶液與等濃度的鹽酸溶液恰好反應呈中性, 消耗的鹽酸多。反應生成的氯化銨溶液呈 (填“酸性” 、“中性” 或 “堿性”),其原因是(用離子方程式表示)
③向氨水溶液中加入一定量的鹽酸溶液,當測得溶液的pH=7時,溶液中離子的濃度大小為
(選填字母,下同),當測得溶液的pH>7時,溶液中離子的濃度大小為 。
a.c(NH4+)>c(Cl—)>c(OH—)>c(H+) b.c(NH4+) = c(Cl—)>c(OH—) =c(H+)
c.c(Cl—)>c(NH4+)>c(H+)>c(OH—) d.c(NH4+)>c(Cl—)>c(H+)>c(OH—)
(2)向盛有1mL0.1mol/LMgCl2溶液的試管中滴加2滴2mol/L KOH溶液,有白色沉淀生成,再滴加2滴0.1mol/LFeCl3溶液,靜置。可以觀察到的現象是 ,產生該現象的原因是(用離子方程式和簡要文字表達)
查看答案和解析>>
科目:高中化學 來源: 題型:
A、B、C、D、E五種短周期元素,原子序數依次增大,A、E同主族,A元素的原子半徑最小,B元素原子的最外層電子數是內層電子數的2倍,C元素的最高價氧化物的水化物X與其氫化物反應生成一種鹽Y,A、B、C、E四種元素都能與D元素形成原子個數比不相同的常見化合物.回答下列問題:
(1)常溫下,X、Y的水溶液的pH均為5.則兩種水溶液中由水電離出的H+濃度之比
是 .
(2)A、B、D、E四種元素組成的某無機化合物,受熱易分解。寫出少量該化合物溶液與
足量的Ba(OH)2溶液反應的離子方程式 .
(3)在一個裝有可移動活塞的容器中進行如下反應:C2(g)+3A2(g)![]() 2CA3(g)
2CA3(g)
ΔH=-92.4 kJ·mol-1.反應達到平衡后,測得容器中含有C2 0.5mol,A2 0.2mol,CA3 0.2 mol,總容積為1.0 L.
①如果達成此平衡前各物質起始的量有以下幾種可能,其中不合理的是________:
A.C2 0.6mol,A2 0.5mol,CA3 0mol B.C2 0mol,A2 0mol,CA3 1.2mol
C.C2 0.5mol/L,A2 0.3mol/L,CA3 0.2mol/L
②若起始加入1.2molC2、1.0molA2,達平衡后C2的濃度為__________mol/L
③如果保持溫度和壓強不變,向上述平衡體系中加入0.18molC2,平衡將________(填“正向”、“逆向”或“不”)移動.
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com