
【題目】硫酸亞鐵銨[(NH4)2Fe(SO4)2·6H2O],俗名莫爾鹽,藍綠色的固體,易溶于水,幾乎不溶于乙醇,在 100℃~110℃時分解,對光敏感。在空氣中逐漸風化及氧化。在空氣中比硫酸亞鐵穩定,有還原性。常用作重鉻酸鉀、高錳酸鉀等溶液的互相標定的標準物質。一般用廢鐵屑經以下流程制取:

(1)檢驗莫爾鹽固體中亞鐵離子,可將樣品溶于水后,滴加 K3[Fe(CN)6]溶液,反應的現象是________________。
(2)下列說法中正確的有____。
A.用 NaOH 溶液洗滌廢鐵屑的作用是去除廢鐵屑表面的油污和氧化鐵雜質
B.蒸發應用小火小心加熱,直到出現大量晶體停火利用余熱蒸干溶劑
C.過濾后可用少量乙醇洗滌
D.檢驗莫爾鹽固體樣品中銨離子,可將樣品溶于水后,再加足量 NaOH 稀溶液,將濕潤的紅色石蕊試紙置于試管口,若觀察到試紙變藍,表明固體中存在 NH4+,否則無 NH4+
E.檢驗莫爾鹽固體是否氧化變質,可將樣品溶于水后,滴加 KSCN 溶液,溶液變紅,說明氧化變質
(3)用重鉻酸鉀溶液標定(滴定)莫爾鹽溶液濃度,若需配制濃度為 0.01000molL-1 的 K2Cr2O7 標準溶液 250mL,應準確稱取____________________g K2Cr2O7(保留 4 位有效數字,已知 M( K2Cr2O7)=294.0gmol-1).配制該標準溶液時,下列儀器中不必要用到的有__________________ .
①電子天平 ②燒杯 ③溫度計 ④玻璃棒 ⑤容量瓶⑥鐵架臺(帶鐵圈) ⑦膠頭滴管
滴定操作中,如果滴定前裝有 K2Cr2O7 標準溶液的滴定管尖嘴部分有氣泡,而滴定結束后氣泡消失,則測定結果將____(填“偏大”、“偏小”或“不變”)。
(4)向(NH4)2Fe(SO4)2 溶液中滴加一定量的 NaOH 溶液時,發生的總反應的離子方程式一定錯誤的是____。(填字母)
A.Fe2++2OH-===Fe(OH)2↓
B.NH4++OH-===NH3·H2O
C.Fe2++3OH-+NH4+===Fe(OH)2↓+NH3·H2O
D.Fe2++5OH-+3NH4+===Fe(OH)2↓+3NH3·H2O
【答案】出現藍色沉淀 CE 0.7350g ③⑥ 偏大 BD
【解析】
(1) Fe2+的溶液與鐵氰化鉀K3[Fe(CN)6]溶液反應生成具有特征藍色的鐵氰化亞鐵沉淀。
(2) NaOH 溶液可以去除廢鐵屑表面的油污;硫酸亞鐵銨在 100℃~110℃時分解,蒸發時應用小火小心加熱,待晶膜出現,停火利用余熱蒸發溶劑,過濾所得懸濁液;因為硫酸亞鐵銨易溶于水,幾乎不溶于乙醇,故過濾后用少量乙醇洗滌;檢驗銨離子,利用銨根離子可以和強堿反應生成氨氣,但氨氣極易溶于水,注意溶液反應的時候需要加熱;鐵離子(Fe3+)與SCN-反應生成顯血紅色絡合物,是檢驗鐵離子的常用方法。
(3)計算K2Cr2O7的質量可以用m=M×n進行計算;配置一定物質的量濃度的溶液需要用到的儀器:容量瓶(應注明體積),燒杯,量筒,天平,玻璃棒,滴管;滴定溶液的影響因素根據c(待測)=![]() ,分析操作對待測液的物質的量濃度的影響。
,分析操作對待測液的物質的量濃度的影響。
(4)加入 NaOH 溶液時,Fe2+先反應,NH4+后反應。
(1)K3[Fe(CN)6]檢驗 Fe2+,會生成 Fe3[Fe(CN)6]2 特征藍色沉淀
(2)用 NaOH 溶液洗滌廢鐵屑的作用是去除廢鐵屑表面的油污,但 NaOH 溶液并不能和鐵的氧化物雜質反應;硫酸亞鐵銨在 100℃~110℃時分解,故蒸發應用小火小心加熱,蒸發溶劑直到晶膜出現,停火利用余熱蒸發溶劑,得到的是濁液,分離操作是過濾,而不能蒸干后轉移;又因硫酸亞鐵銨易溶于水,幾乎不溶于乙醇,故過濾后用少量乙醇洗滌;檢驗銨離子,可將樣品溶于水后,再加足量 NaOH 溶液,并加熱,將濕潤的紅色石蕊試紙置于試管口,若觀察到試紙變藍,表明固體中存在 NH4+;固體在空氣中氧化變質會生成鐵離子,檢驗鐵離子可將樣品溶于水后,滴加 KSCN 溶液,溶液變紅,說明氧化變質。故選 CE。
(3)用重鉻酸鉀溶液標定莫爾鹽溶液的反應為 6Fe(NH4)2(SO4)2+7H2SO4+K2Cr2O7= Cr2(SO4)3+3Fe2(SO4)3+K2SO4+7H2O+6(NH4)2SO4m(K2Cr2O7)=0.01000molL-1×0.250 L×294.0 gmol-1=0.7350g;根據溶液濃度的精度,應選擇電子天平用于稱量固體質量,燒杯用于溶解固體,玻璃棒用于攪拌和引流操作,容量瓶用于配置溶液,膠頭滴管用于加水定容.故用不到的儀器為溫度計和鐵架臺;如果滴定前裝有 K2Cr2O7標準溶液的滴定管尖嘴部分有氣泡,這樣就造成讀數偏小;滴定結束后氣泡消失,這樣讀數就正常,所以讀出來的 K2Cr2O7 標準溶液體積偏大,測定結果將偏大,故答案為:0.7350g;③⑦;偏大。
(4)由于加入 NaOH 溶液時,Fe2+先反應,NH4+后反應,所以若 NaOH 量不足,可能只有 Fe2+發生反應,所以 A 正確、B 錯誤;也可能 Fe2+ 完全反應而 NH4+部分或完全反應,即離子方程式中 n(NH4+):n(Fe2+)≤ 2:1,所以 C 正確 D 錯誤,故答案為:BD。


 教材全解字詞句篇系列答案
教材全解字詞句篇系列答案科目:高中化學 來源: 題型:
【題目】下列屬于取代反應的是( )
A. 乙烯與水反應生成乙醇 B. 甲烷與氯氣反應生成一氯甲烷
C. 乙醇與氧氣反應生成乙醛 D. 乙烯與高錳酸鉀溶液反應生成CO2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】四種短周期元素 X、Y、Z 和 W 在元素周期表中的位置如圖所示,原子序數之和為 48。下列有關說法中正確的是
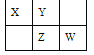
A. 原子半徑(r)大小比較 r(X)< r(Y)
B. Z 和 Y 可形成共價化合物 YZ3
C. W 的非金屬性比 Z 的強,所以 W 的簡單氣態氫化物的沸點比 Z 的高
D. W 的最低價單核陰離子的失電子能力比 X 的弱
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】亞磷酸(H3PO3)是二元弱酸,亞磷酸主要用作尼龍增白劑,電解Na2HPO3溶液也可得到亞磷酸,裝置示意圖如圖(其中陽膜只允許陽離子通過,陰膜只允許陰離子通過)。下列說法不正確的是

A. 陽極的電極反應式為2H2O-4e-![]() 4H++O2↑
4H++O2↑
B. 產品室中發生的離子反應為HPO32-+2H+![]() H3PO3
H3PO3
C. 原料室中Na+濃度保持不變
D. 陰極室中溶液的pH逐漸升高
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:Al、Fe、Cu 的合金與稀硝酸反應生成的氣體只有 NO,實驗過程如下:
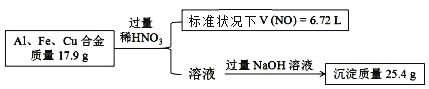
另取等量該合金,溶于足量 NaOH (aq),則可得氣體的物質的量是
A. 0.22 mol B. 0.15 mol C. 0.3 mol D. 無法計算
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】科學家從化肥廠生產的(NH4)2SO4中檢出組成為N4H4(SO4)2的物質,經測定,該物質易溶于水,在水中以SO42-和N4H44+兩種離子形式存在,植物的根系極易吸收N4H44+,但它遇到堿時,會生成一種形似白磷的N4分子,N4分子不能被植物吸收。

請回答下列問題:
(1)下列相關說法中,正確的是________(填序號)。
a.N4是N2的同分異構體
b.1 mol N4分解生成N2,形成了4 molπ鍵
c.白磷的沸點比N4高,是因為P-P鍵鍵能比N-N鍵能大
d.白磷的化學性質比N2活潑,說明P的非金屬性比N強
(2)已知白磷、NH4+ 、N4H44+的空間構型均為四面體結構,參照NH4+和白磷的結構式,畫出N4H44+的結構式(配位鍵用![]() 表示)________________;
表示)________________;
(3)在葉綠素結構示意圖上標出N與Mg元素之間的配位鍵和共價鍵(配位鍵用![]() 表示)_______
表示)_______
(4)疊氮化物是研究較早的含全氮陰離子的化合物,如:氫疊氮酸(HN3)、疊氮化鈉(NaN3)等。根據等電子體理論寫出N3-的電子式_____________;疊氮化物能形成多種配合物,在[Co(N3)(NH3)5]SO4,其中鈷顯____價,它的配體是 ________________,寫一種與SO42-等電子體的分子 ________________。
(5)六方相氮化硼晶體內B-N鍵數與硼原子數之比為_______,其結構與石墨相似卻不導電,原因是_______________________________________。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】溶液X中可能含有K+、Mg2+、Al3+、AlO、SiO、CO、SO、SO中的若干種離子。某同學對該溶液進行了如下實驗:

下列判斷正確的是( )
A. 氣體甲一定是純凈物 B. 沉淀甲是硅酸和硅酸鎂的混合物
C. K+、AlO和SiO一定存在于溶液X中 D. CO和SO一定不存在于溶液X中
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】CuBr是一種白色晶體,見光或潮濕時受熱易分解,在空氣中逐漸變為淺綠色。實驗室制備CuBr的反應原理為:SO2+2CuSO4+2NaBr+ 2H2O=2CuBr↓+2H2SO4+Na2SO4,用下列裝置進行實驗,不能達到實驗目的的是
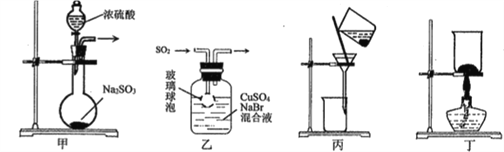
A. 用裝置甲制取SO2 B. 用裝置乙制取CuBr
C. 用裝置丙避光將CuBr與母液分離 D. 用裝置丁干燥CuBr
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ.氮的固定一直是科學家研究的重要課題,合成氨則是人工固氮比較成熟的技術,其原理為N2 (g)+3H2 (g)![]() 2NH3(g)
2NH3(g)
(1)已知每破壞1mol有關化學鍵需要的能量如下表:
H-H | N-H | N-N | N≡N |
435.9kJ | 390.8kJ | 192.8kJ | 945.8kJ |
(1)則反應物的總能量_________(填“>”或 “<”)生成物的總能量
(2)在一定溫度下、向2L密閉容器中加入2 molN2、6 mol H2,在適當的催化劑作用下,發生反應 N2 (g)+3H2 (g)![]() 2NH3(g),10min后達到平衡,此時剩余4.5mol H2。
2NH3(g),10min后達到平衡,此時剩余4.5mol H2。
①下列敘述能說明此反應達到平衡狀態的是____。
a.容器內總壓強不變 b.v(H2)正=v(H2)逆 c.N2和H2的濃度相等
d. 2 mol NH3生成的同時有3 moH—H鍵斷裂 e.NH3的濃度不再改變
②0~10 min內的平均反應速率v(H2) 是____mol/(Lmin);10秒末NH3的濃度是___mol/L;N2 的的物質的量___mol
Ⅱ.某溫度時,在一個2L的密閉容器中X、Y、Z三種氣體物質的物質的量隨時間的變化曲線如圖所示,據此回答:
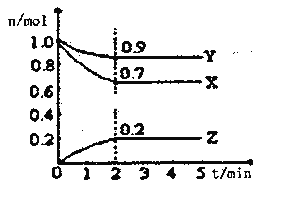
(1)該反應的化學方程式為___________
(2)從開始至2min,Z的平均反應速率為____________;
(3)改變下列條件,可以加快化學反應速率的有_________
A.升高溫度 B.減小物質X的物質的量 C.減小壓強 D.增加物質Z的物質的量. E.加入某種催化劑 F.縮小容積 G.使用效率更高的催化劑
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com