
【題目】[化學——選修3:物質結構與性質]利用元素周期表中同族元素的相似性,可預測元素的性質。
(1)寫出P元素的基態原子的核外電子排布式:__________,P元素的基態原子有_________個未成對電子。
(2)白磷的分子式為P4,其結構如下圖所示。
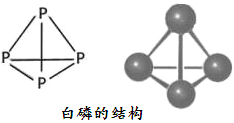
科學家目前合成了 N4分子,在N4分子中N原子的雜化軌道類型是___________,N—N鍵的鍵角為_____________
(3)N、P、As原子的第一電離能由大到小的順序為_____________。
(4)立方氮化硼晶體的結構如下圖所示:
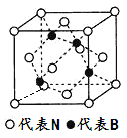
立方氮化硼晶體中,每個晶胞中B原子的個數為_____________。
(5)N與As是同族元素,B與Ga是同族元素,立方砷化鎵晶體與立方氮化硼晶體結構類似,兩種晶體中熔點較高的是____________;立方砷化鎵晶體的晶胞邊長為a pm(1pm=1×10-12m),則其密度為____________g·cm-3(用含a的式子表示,設NA為阿伏加德羅常數的值)。
【答案】(1)1s22s22p63s23p3或[Ne]3s23p3,3;
(2)sp3,60o;(3)N>P>As;(4)4;
(5)氮化硼(BN)晶體;(145×4)/[NA·(a×10-10)3]或5.8×1032/(NA·a3)。
【解析】試題分析:(1)P屬于15號元素,位于第三周期第VA族,核外電子排布式1s22s22p63s23p3或[Ne] 3s23p3,p能級有三個空軌道,每一個電子優先占據一個軌道,且自旋方向相同,因此有3個未成對電子;(2)根據白磷的分子結構,每一個氮原子有3個σ鍵,一個孤電子對,因此雜化類型為sp3,白磷的空間構型為正四面體,但鍵角是60o;(3)同主族從上到下第一電離能減小,即N>P>As;(4)根據晶胞的結構,B原子全部位于晶胞內,因此每個晶胞有4個B原子;(5)兩者為原子晶體,N-B的鍵長比Ga-As的鍵長短,因此沸點高的是BN,此晶胞中含B原子數為4個,晶胞的質量為4×145/NAg,晶胞的體積為(a×10-10)3cm3,因此密度為:(145 × 4)/ [NA· (a×10-10)3]或5.8×1032/(NA·a3)。


科目:高中化學 來源: 題型:
【題目】下列關于有機化合物的認識正確的是( )
A.油脂在空氣中完全燃燒生成H2O和CO2
B.淀粉和纖維素互為同分異構體
C.金屬鈉可區分乙醇和乙酸
D.苯與飽和溴水混合,發生了取代反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NaCl是海水中提取出來的一種重要物質,除可食用外,它還是一種重要的工業原料,下列以NaCl為原料的產品(或物質)是( )
① 燒堿 ② 純堿 ③ 金屬鈉 ④ 氯氣 ⑤ 鹽酸 ⑥ NaClO
A.全部 B.①②③④⑤ C.①②③⑤⑥ D.①②④⑤⑥
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】空氣吹出法是最早工業化海水提溴的方法,適合從低濃度含溴溶液中提取溴。
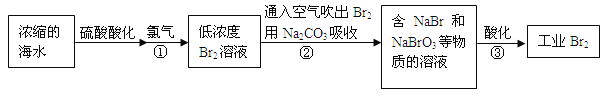
(1)NaBr的電子式是 。
(2)反應①是將Br—轉化為Br2,反應①的離子方程式是 。
(3)通入空氣吹出Br2,并用Na2CO3吸收的目的是 。
(4)反應②的化學方程式是 。
(5)反應③中每生成3 mol Br2,轉移電子的物質的量是 mol。
(6)為了除去工業Br2中微量的Cl2,可向工業Br2中 (填字母)。
a.通入HBrb.加入NaBr溶液 c.加入Na2CO3溶液 d.加入Na2SO3溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述正確的是
A. 常溫下,78 g Na2O2中含有的陰離子數是2NA
B. 常溫下,l L 0.l mol·L-1NH4NO3溶液中含有的NH4+ 數是0.l NA
C. 常溫常壓下,22.4 L SO2和O2混合氣體中含有的氧原子數是2 NA
D. 鐵鋁混合物與一定量鹽酸反應生成1 mol H2時,轉移電子數是2 NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】固體NH5屬于離子晶體。它與水反應的化學方程式為NH5+H2O→NH3·H2O+H2↑,它也能跟乙醇發生類似的反應,并都產生氫氣。下列有關NH5敘述正確的是
A.含有NH4+和H-
B.NH5中N元素的化合價為+5價
C.1 mol NH5中含有5NA個N—H鍵
D.與乙醇反應時,NH5被還原
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列物質中不能用化合反應的方法制得的是
①SiO2 ②H2SiO3 ③Fe(OH)3 ④CuS ⑤FeCl2 ⑥ CaSiO3
A.②④ B. ②④⑤ C.②③④⑤ D.②④⑥
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】I.工業上利用H2和CO2合成二甲醚的反應如下:6H2(g)+2CO2(g) ![]() CH3OCH3(g)+3H2O(g) ΔH<0
CH3OCH3(g)+3H2O(g) ΔH<0
溫度升高,該化學平衡移動后到達新的平衡,CH3OCH3的產率將________(填“變大”、“變小”或“不變”,下同),混合氣體的平均相對分子質量將________;
Ⅱ.某科研小組欲研究在其他條件不變的情況下,改變起始氧氣的物質的量對合成新型硝化劑反應 4NO2(g)+O2(g) ![]() 2N2O5(g) ΔH<0的影響。
2N2O5(g) ΔH<0的影響。
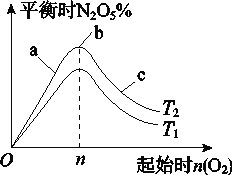
(1)圖像中T1和T2的關系是T1________T2(填“>”、“<”或“=”);
(2)比較a、b、c三點所處的平衡狀態中,反應物NO2的轉化率最大的是________(填字母);
(3)若起始時NO2是4mol,容器體積為1 L,n=1 mol,NO2的轉化率為50%,則此條件下(T2),反應的平衡常數為_________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com