
【題目】【化學選修3—物質結構與性質】
A、B、W、D、L為短周期元素,且原子序數依次增大,質子數之和為39,B、W同周期,A、D同主族,A、W能形成兩種液態化合物A2W和A2W2,E元素的周期序數與主族序數相等。
(1)W2-離子的結構示意圖為__________,E元素在周期表中的位置為_________,寫出E的最高價氧化物與D的最高價氧化物的水化物反應的離子方程式____________________。
(2)經測定A2W2為二元弱酸,A2W2的電子式為____________,常用硫酸處理BaO2來制備A2W2,寫出該反應的化學方程式___________________。
(3)向含有Fe2+和淀粉KI的酸性溶液中滴入A2W2,觀察到溶液呈藍色并有紅褐色沉淀生成,當消耗2molI-時,共轉移3mol電子,該反應的離子方程式是________________。
(4)元素D的單質在一定條件下,能與A單質化合生成一種化合物DA,熔點為800℃,能與水反應放氫氣,寫出該反應方程式_____________,若將1molDA和1molE單質混合加入足量的水,充分反應后生成氣體的體積是_____________L(標準狀況下)。
【答案】(1)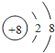 (1分),第三周期第ⅢA族;(2分)
(1分),第三周期第ⅢA族;(2分)
Al2O3+2OH﹣=2AlO2﹣+H2O;(2分)
(2)![]() (2分) BaO2+H2SO4=BaSO4↓+H2O2;(2分)
(2分) BaO2+H2SO4=BaSO4↓+H2O2;(2分)
(3)2Fe2++4I﹣+3H2O2=2Fe(OH)3↓+2I2;(2分)
(4)NaH+H2O=NaOH+H2↑,(2分) 56(2分)
【解析】試題分析:A、B、W、D、L為短周期元素,且原子序數依次增大,A、W能形成兩種液態化合物A2W和A 2W2,則A為H,W為O,A、D同主族,D為Na,;進而可知D為Na,E元素的周期序數與主族序數相等,可知E為Al,再由五元素質子數之和為39可知B為C元素。
(1)W為8號元素O,O2-離子的結構示意圖為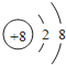 ,E為Al元素,Al有3個電子層,最外層有3個電子,在周期表中的位置為第三周期第ⅢA族,E的最高價氧化物為Al2O3,D的最高價氧化物的水化物為NaOH,氧化鋁與NaOH溶液反應生成偏鋁酸鈉和水,反應的離子方程式為Al2O3+2OH﹣=2AlO2﹣+H2O。
,E為Al元素,Al有3個電子層,最外層有3個電子,在周期表中的位置為第三周期第ⅢA族,E的最高價氧化物為Al2O3,D的最高價氧化物的水化物為NaOH,氧化鋁與NaOH溶液反應生成偏鋁酸鈉和水,反應的離子方程式為Al2O3+2OH﹣=2AlO2﹣+H2O。
(2)經測定H2O2為二元弱酸,H2O2為共價化合物,H2O2的電子式為![]() ,硫酸與BaO2反應生成H2O2,依據強酸制弱酸原理,可知反應的化學方程式為BaO2+H2SO4=BaSO4↓+H2O2。
,硫酸與BaO2反應生成H2O2,依據強酸制弱酸原理,可知反應的化學方程式為BaO2+H2SO4=BaSO4↓+H2O2。
(3)向含有Fe2+和淀粉KI的酸性溶液中滴入H2O2,觀察到溶液呈藍色并有紅褐色沉淀生成,說明H2O2能將KI氧化成碘單質,同時將Fe2+氧化成Fe(OH)3沉淀,根據題意消耗2molI-時,共轉移3mol電子,根據得失電子守恒、電荷守恒和原子守恒配平,該反應的離子方程式是2Fe2++4I﹣+3H2O2=2Fe(OH)3↓+2I2;
(4)元素D的單質為金屬Na,在一定條件下,Na能與H2化合生成化合物NaH,NaH能與水反應放出氫氣,則該反應方程式為NaH + H2O =" NaOH" + H2↑,將1molNaH和1molAl混合加入足量的水,發生的反應依次為NaH+H2O=NaOH+H2↑、2Al+2NaOH+2H2O =2NaAlO2+3H2↑,得2Al+2NaH+4H2O=2NaAlO2+5H2↑,即可生成2.5molH2,體積為22.4L/mol×2.5mol=56L。


 新題型全程檢測期末沖刺100分系列答案
新題型全程檢測期末沖刺100分系列答案科目:高中化學 來源: 題型:
【題目】I.明礬石的主要成分是K2SO4·Al2(SO4)3·2Al2O3·6H2O,還含有少量Fe2O3雜質,可利用明礬石制備氫氧化鋁。
(1)已知明礬石脫水后要硫化,化學方程式為2Al2(SO4)3+3S![]() 2Al2O3+9SO2,該反應的氧化劑與還原劑的物質的量之比是___________;若生成1 mol Al2O3,則轉移的電子數為________。
2Al2O3+9SO2,該反應的氧化劑與還原劑的物質的量之比是___________;若生成1 mol Al2O3,則轉移的電子數為________。
(2)證明廢渣中含有Fe2O3 的化學方法:_____________________。
II.鎂鋁合金(Mg17Al12 )是一種潛在的貯氫材料,可在氬氣保護下,將一定化學計量比的Mg、Al 單質在一定溫度下熔煉獲得。該合金在一定條件下完全吸氫的反應方程式為:Mg17Al12 + 17H2=17MgH2 + 12Al ,得到的混合物Y(17MgH2 +12Al)在一定條件下可釋放出氫氣。
(3)熔煉制備鎂鋁合金(Mg17Al12)時通入氬氣的目的是_____________________
(4)在6.0 mol·L-1 HCl 溶液中,混合物Y 能完全釋放出H2。1 mol Mg17Al12 完全吸氫后得到的混合物Y 與上述鹽酸完全反應,釋放出H2的物質的量為_______mol。(已知:MgH2 + 2HCl = MgCl2 + 2H2↑)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A. 第三周期所含的元素中鈉的第一電離能最小
B. 鋁的第一電離能比鎂的第一電離能大
C. 在所有元素中,氟的第一電離能最大
D. 鉀的第一電離能比鎂的第一電離能大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向含Na2CO3、NaAlO2的混合溶液中逐滴加入150mL 1molL-1的HCl溶液,測得溶液中的某幾種離子物質的量的變化如圖所示,則下列說法不正確的是( )
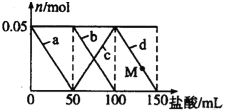
A. a曲線表示的離子方程式為:AlO2-+H++H2O=Al(OH)3
B. b和c曲線表示的離子反應是相同的
C. M點時Al(OH)3的質量小于3.9g
D. 原混合溶液中的CO32-與AlO2-的物質的量之比為2:1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A.有機物中都存在同分異構現象
B.只要含有的官能團種類相同就是同系物
C.14C和14Si是同位素
D.C2H5Cl沒有同分異構體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用惰性電極電解一定濃度的額CuSO4溶液時,通電一段時間后,向所得的溶液中加入0.1mol Cu2(OH)2CO3后恰好恢復到電解前的濃度和PH(不考慮二氧化碳的溶解)。則電解過程中轉移的電子的物質的量為
A.0.4mol B.0.5mol C.0.6mol D.0.8mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲、乙、丙、丁四位同學分別進行實驗,測定四份不同澄清溶液的成分,記錄如下
表,其中記錄合理的是
甲 | K2SO4、BaCl2、NH4NO3 |
乙 | NaCl、Ca(OH)2、K2CO3 |
丙 | HCl、Na2SO3、NaCl |
丁 | K2SO4、NaNO3、KCl |
A.甲 B.乙 C.丙 D.丁
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com