
【題目】三氯化釕是一種重要的貴金屬化合物,廣泛應用于氯堿工業中金屬陽極釕涂層及加氫催化劑。
I.三氯化釕的制備
將金屬釕粉與氯化鈉混合后,加入微量還原性淀粉,將溫度升高到800~1000°C,再往熔融的熔體中通入氯氣,大部分釕粉轉化為氯釕酸鈉(Na2RuCl6),再經過一系列化學工藝制備出三氯化釕。
(1)生成氯釕酸鈉的化學方程式為__________________
(2)升溫階段加入還原性淀粉的作用是__________________
II.三氯化釕的回收
從廢棄催化劑回收三氯化釕的一種工藝流程如下圖所示:
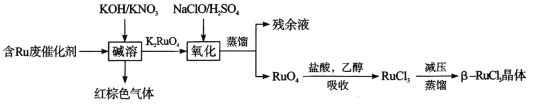
回答下列問題:
(3)“氧化”時加H2SO4的目的______________________
(4)“吸收”過程中加入乙醇的作用是__________________________
(5)可用氫還原重量法測定產品的純度,其原理為2RuCl3+3H2==2Ru+6HCl。某同學對產品純度進行測定,所得數據記錄如下:

則產品的純度為________(用百分數表示,保留兩位有效數字)
(6)釕及其化合物在合成工業.上有廣泛用途,下圖是用釕( Ru)基催化劑催化合成甲酸的過程。每生成92g液態HCOOH放出62.4kJ的熱量。
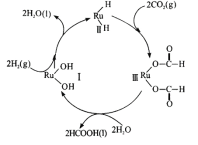
①根據圖示寫出該反應的熱化學方程式_______________
②下列說法正確的是________
a.圖示中物質I為該反應的催化劑
b.圖示中參與循環的物質只有CO2和H2
c.反應的活化能為62.4 kJ·mol -1
【答案】Ru+2Cl2+2NaCl![]() Na2RuCl6 保持還原性反應環境,防止金屬釕被空氣中氧氣氧化 NaClO在酸性環境下氧化性增強 增加RuO4在溶液中的溶解性 82% H2(g)+CO2(g)=HCOOH(l) △H=-31.2kJ·mol-1 a
Na2RuCl6 保持還原性反應環境,防止金屬釕被空氣中氧氣氧化 NaClO在酸性環境下氧化性增強 增加RuO4在溶液中的溶解性 82% H2(g)+CO2(g)=HCOOH(l) △H=-31.2kJ·mol-1 a
【解析】
II.含Ru廢催化劑加入KOH/KNO3混合溶液浸取,硝酸根在堿性環境下將Ru元素氧化為K2RuO4,自身被還原成紅棕色氣體NO2,之后再加入硫酸酸化的次氯酸鈉,將K2RuO4氧化為RuO4,蒸餾得到RuO4,加鹽酸和乙醇混合液進行吸收,得到RuCl3溶液,之后進行減壓蒸餾得到β—RuCl3晶體;
Ⅲ.H2和物質I反應生成水和物質Ⅱ,之后物質II和CO2反應生成物質Ⅲ,之后物質Ⅲ和水反應生成物質I和HCOOH,所以物質I為催化劑,氫氣和二氧化碳為反應物
I.(1)根據題意反應物有Ru、NaCl以及氯氣,產物有Na2RuCl6,該過程中Ru元素被氧化成+4價,Cl元素被還原成-1價,根據電子守恒和元素守恒可得化學方程式為Ru+2Cl2+2NaCl![]() Na2RuCl6;
Na2RuCl6;
(2)空氣中的氧氣具有氧化性,升溫階段加入還原性淀粉可以保持還原性反應環境,防止金屬釕被空氣中氧氣氧化;
II.(3)酸性環境下可以增強NaClO的氧化性;
(4)加入乙醇可以增大RuO4在溶液中的溶解度;
(5)根據三組實驗數據得到的Ru單質的平均質量為![]() =0.500g,根據方程式可知樣品中RuCl3的質量為
=0.500g,根據方程式可知樣品中RuCl3的質量為![]() =1.0272g,則樣品的純度為
=1.0272g,則樣品的純度為![]() =82%;
=82%;
(6)①根據整個流程可知,CO2和H2為反應物,產物為HCOOH,92gHCOOH的物質的量為![]() =2mol,所以生成1mol液體HCOOH放出31.2kJ能量,熱化學方程式為H2(g)+CO2(g)=HCOOH(l)△H=-31.2kJ·mol-1;
=2mol,所以生成1mol液體HCOOH放出31.2kJ能量,熱化學方程式為H2(g)+CO2(g)=HCOOH(l)△H=-31.2kJ·mol-1;
②a.據圖可知物質I雖然參與整個過程,但整個反應前后沒有變化,且反應從物質I和氫氣的反應開始,所以為該反應的催化劑,故a正確;
b.據圖可知催化劑雖然整個過程前后質量和化學性質沒有變化,但也參與了整個循環,故b錯誤;
c.每生成2mol HCOOH放出62.4kJ的能量,據此可知反應物和生成物的能量之差,不能確定反應的活化能,故c錯誤;
綜上所述選a。


科目:高中化學 來源: 題型:
【題目】設![]() 為阿伏加德羅常數的值。下列說法正確的是( )
為阿伏加德羅常數的值。下列說法正確的是( )
A.標準狀況下,![]() 苯中含有
苯中含有![]() 個苯分子
個苯分子
B.標準狀況下,![]() 分別與足量的鐵和銅充分反應,轉移的電子總數之比為
分別與足量的鐵和銅充分反應,轉移的電子總數之比為![]()
C.![]() 溶液中,陽離子和陰離子的數目之比為
溶液中,陽離子和陰離子的數目之比為![]()
D.![]() 中含有的共價鍵數為
中含有的共價鍵數為![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖是中學化學中常用于混合物的分離和提純的裝置,請根據裝置回答問題:
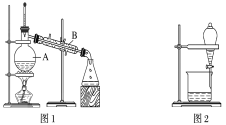
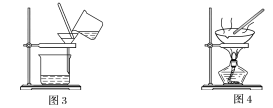
(1)裝置圖1中B的名稱是________________,圖2中漏斗的名稱是________________。A中一般要加入碎瓷片,其作用是__________________________。下列關于以上實驗操作說法一定正確的是_。
A.圖1實驗中,加熱一段時間后發現未加入碎瓷片,應馬上添加,以防發生危險
B.圖2實驗中,應打開活塞,將有機溶劑從下端導管中放出
C.圖3實驗中,可以用玻璃棒在漏斗中攪拌,以加快過濾速度
D.圖4實驗中,當加熱至有較多固體析出時,即停止加熱
(2)現有一瓶A和B的混合液,已知它們的性質如下表。
物質 | 熔點/℃ | 沸點/℃ | 密度/g·cm-3 | 溶解性 |
A | -11.5 | 198 | 1.11 | A、B互溶,且均易溶于水和酒精 |
B | 17.9 | 290 | 1.26 |
據此分析,將A和B相互分離可選用上圖中的圖________________所示儀器。
(3)在圖2所示實驗中,靜置分層后,如果不知道哪一層液體是“水層”,試設計一種簡便的判斷方法。____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下面均是正丁烷與氧氣反應的熱化學方程式(25℃、101kPa):
①C4H10(g)+![]() O2(g)═ 4CO2(g)+5H2O(l);△H=-2 878kJ/mol
O2(g)═ 4CO2(g)+5H2O(l);△H=-2 878kJ/mol
②C4H10(g)+![]() O2(g)═ 4CO2(g)+5H2O(g);△H=-2 658kJ/mol
O2(g)═ 4CO2(g)+5H2O(g);△H=-2 658kJ/mol
③C4H10(g)+![]() O2(g)═ 4CO(g)+5H2O(l);△H=-1 746kJ/mol
O2(g)═ 4CO(g)+5H2O(l);△H=-1 746kJ/mol
④C4H10(g)+![]() O2(g)═ 4CO(g)+5H2O(g);△H=-1 526kJ/mol
O2(g)═ 4CO(g)+5H2O(g);△H=-1 526kJ/mol
由此判斷,正丁烷的燃燒熱為( )
A.2878kJ/molB.2658kJ/molC.1746kJ/molD.1526kJ/mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各組熱化學方程式中,化學反應的△H前者大于后者的是
①C(s)+O(g)=CO(g)ΔH1 ; C(s)+![]() O2(g)=CO(g) ΔH2
O2(g)=CO(g) ΔH2
②S(s)+O2 (g)=SO2 (g) ΔH3 ; S(g)+O2 (g)=SO2 (g) ΔH4
③H2(g)+ ![]() O2(g)=H2O(l) ΔH5;2H2(g)+O2(g)=2H2O(l) ΔH6
O2(g)=H2O(l) ΔH5;2H2(g)+O2(g)=2H2O(l) ΔH6
④CaCO3(s)=CaO(s)+CO2(g) ΔH7;CaO(s)+H2O(l)=Ca(OH)2(s) ΔH8
A. ①B. ④C. ②③④D. ①②③
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ.向體積為2 L的固定密閉容器中通入3 mol X氣體,在一定溫度下發生如下反應:2X(g)![]() Y(g)+3Z(g)。經5 min后反應達到平衡,此時測得容器內的壓強為起始時的1.2倍,則用Y表示的化學反應速率為____________,X的轉化率為__________,Z的平衡濃度為_______________。
Y(g)+3Z(g)。經5 min后反應達到平衡,此時測得容器內的壓強為起始時的1.2倍,則用Y表示的化學反應速率為____________,X的轉化率為__________,Z的平衡濃度為_______________。
Ⅱ.一定溫度下,反應N2(g)+O2(g)![]() 2NO(g)在密閉容器中進行,回答下列措施對化學反應速率的影響(填“增大”“減小”或“不變”)。
2NO(g)在密閉容器中進行,回答下列措施對化學反應速率的影響(填“增大”“減小”或“不變”)。
(1)縮小體積使壓強增大:__________;
(2)恒容充入N2:__________;
(3)恒容充入He:__________;
(4)恒壓充入He:__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NA為阿伏加德羅常數的值。下列說法正確的是
A. 1.4gC2H4、C3H6 的混合氣體中,所含碳原子總數為 0. lNA
B. 1.0 mol CH4 與 Cl2 在光照下反應生成的 CH3Cl 分子數為 1.0NA
C. 標準狀況下,22. 4LC2H6 中所含極性共價鍵的數目為 7NA
D. 50mL l2mol·L 的濃鹽酸與足量 MnO2 反應,轉移電子總數為 0. 3NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)堿洗鋁材除其表面的氧化膜,堿洗時常有氣泡冒出,原因是___(用離子方程式表示)。為將堿洗后溶液中的鋁以沉淀形式回收,最好應加入下列試劑中的____(填字母)。
a.稀H2SO4 b.鹽酸 c.CO2 d.氨水 e.NaOH
(2)某校化學興趣小組用如圖所示過程除去AlCl3中含有的Mg2+、K+雜質離子并盡可能減少AlCl3的損失。請回答下列問題:
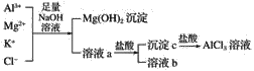
①寫出混合物中加入足量氫氧化鈉溶液時,溶液中發生反應的離子方程式:___,__,___。
②氫氧化鈉溶液能否用氨水代替,為什么?___。
③溶液a中存在的離子有___,在溶液a中加入鹽酸時需控制鹽酸的量,為什么?___,為此,改進方法是___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】標準狀況下,某氣態烷烴和烯烴(含一個雙鍵)的混合氣體2.24 L完全燃燒后,將產生的氣體緩慢通過濃硫酸,濃硫酸增重4.05 g,剩余氣體通過堿石灰,堿石灰增重6.60 g。另再取2.24 L標準狀況下的該混合氣體,將它通入過量的溴水中,溴水增重1.05 g。
(1)確定混合氣體由哪兩種烴組成_______。
(2)計算混合氣體中兩種烴的體積分數_______。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com