
下列反應中有關電子轉移的數目分析正確的是
A.某密閉容器盛有2molN2和6molH2,在一定條件下充分反應,轉移電子的數目為12NA
B.標準狀況下,1molCl2溶于水,轉移的電子數目為NA
C.50mL 18.4mol/L濃硫酸與足量銅微熱反應生成SO2,轉移的電子數目為0.92NA
D.一定條件下,4.6g的Na完全與O2反應生成7.2g產物時失去的電子數目為0.2NA
 世紀百通期末金卷系列答案
世紀百通期末金卷系列答案科目:高中化學 來源: 題型:
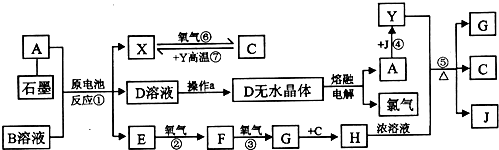


| ||
| ||
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、將第⑤步得到的溶液再用肼還原,則溶液中I-濃度放大為原溶液中I-濃度的(設放大前后溶液體積相等)18倍 | B、從上述轉化可知,氧化性從強到弱的順序為Cl2>IO3->S4O62->I2 | C、第③步反應中若生成2.24L氣體(標準狀況),則共轉移電子0.6mol | D、原溶液中的I-濃度為0.0040 mol?L-1 |
查看答案和解析>>
科目:高中化學 來源:2013屆遼寧省沈陽市第二十中學高三高考領航考試(三)化學試卷(帶解析) 題型:填空題
【化學——選修化學與技術】(15分)現有一種以黃銅礦和硫磺為原料制取銅和其他產物的新工藝,原料的綜合利用率較高。其主要流程如下:
注:反應Ⅱ的離子方程式為Cu2++CuS+4Cl—=2[CuCl2]-+S
請回答下列問題:
(1)從黃銅礦冶煉粗銅的傳統工藝是將精選后的富銅礦砂與空氣在高溫下煅燒,使其轉變為銅。這種方法的缺點是 _____________________ ________、___________________________________ 。
(2)反應Ⅰ的產物為(填化學式) ___________________ 。
(3)反應Ⅲ的離子方程式為 ____________________________________________________ 。
(4)一定溫度下,在反應Ⅲ所得的溶液中加入稀硫酸,可以析出硫酸銅晶體,其原因是 ___________
(5)黃銅礦中Fe的化合價為+2,對于反應:8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2,下列有關該反應的說法正確的是 ___________________ (填字母)。
8Cu+4FeO+2Fe2O3+16SO2,下列有關該反應的說法正確的是 ___________________ (填字母)。
| A.反應中被還原的元素只有氧 | B.反應生成的SO2直接排放會污染環境 |
| C.SO2既是氧化產物又是還原產物 | D.當有8mol銅生成時,轉移電子數目為100NA |
查看答案和解析>>
科目:高中化學 來源:09-10年遼寧大連23中高二下學期期末考試化學卷 題型:填空題
(7分) 鉻是人體必需元素,如含量不足會影響糖類和脂類的代謝,過高則會引起急性中毒。有關含鉻化合物的相互轉化關系如下

回答下列問題:
(1)鉻原子的電子排布式
(2)上述反應中需用氧化劑的是 (填編號)。
(3)工業上處理含Cr2O72-的廢水時,一般將劇毒的Cr2O72-轉化為Cr3+,寫出以碳為陰極,鐵作陽極,電解處理含NaCl、Cr2O72-的酸性廢水。寫出電極反應和溶液中進行的反應的離子方程式 陽極 陰極
溶液中
(4)反應⑤是可逆反應,在Na2CrO4溶液中加入稀硫酸,溶液由黃色逐漸變成橙色,寫出該反應的離子方程式
(5)已知Ag2CrO4和AgCl的Ksp分別為9.0×10-12、1.56×10-10,向含有相同濃度的Na2CrO4和NaCl的混合溶液中逐滴加入硝酸銀溶液,首先生成的沉淀是
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com