
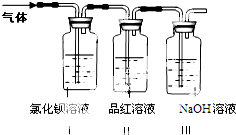
 綠礬是一種重要的化工原料.
綠礬是一種重要的化工原料.
| ||


 培優好卷單元加期末卷系列答案
培優好卷單元加期末卷系列答案科目:高中化學 來源: 題型:閱讀理解
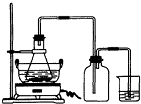 (2009?廣東模擬)綠礬(FeSO4?7H2O)是重要的化學化工試劑,工業上常利用機械加工行業產生的廢鐵屑為原料制備.請回答下列問題:
(2009?廣東模擬)綠礬(FeSO4?7H2O)是重要的化學化工試劑,工業上常利用機械加工行業產生的廢鐵屑為原料制備.請回答下列問題:| 序號 | 反應物用量 | 產品質量 |
| 1 | n(H2SO4):n(Fe)>1:1 | 介于Ⅰ級~Ⅱ級之間 |
| 2 | n(H2SO4):n(Fe)<1:1 | 優于Ⅰ級 |
查看答案和解析>>
科目:高中化學 來源: 題型:

查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
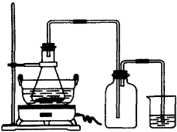 綠礬(FeSO4?7H2O)是重要的化學化工試劑,工業上常利用機械加工行業產生的廢鐵屑為原料制備.
綠礬(FeSO4?7H2O)是重要的化學化工試劑,工業上常利用機械加工行業產生的廢鐵屑為原料制備.| 序號 | 反應物用量 | 產品質量 |
| 1 | n(H2SO4):n(Fe)>1:1 | 介于Ⅰ級~Ⅱ級之間 |
| 2 | n(H2SO4):n(Fe)<1:1 | 優于Ⅰ級 |
查看答案和解析>>
科目:高中化學 來源:2009年廣東省高考化學模擬試卷(二)(解析版) 題型:解答題
| 序號 | 反應物用量 | 產品質量 |
| 1 | n(H2SO4):n(Fe)>1:1 | 介于Ⅰ級~Ⅱ級之間 |
| 2 | n(H2SO4):n(Fe)<1:1 | 優于Ⅰ級 |

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com