
科目:高中化學 來源: 題型:選擇題
| A. | CH2=CH2+Br2→CH2BrCH2Br | B. | 2CH3CH3+Cl2$\stackrel{光照}{→}$2CH3CH2Cl+H2 | ||
| C. | CH3CH2OH+Na→CH3CH2ONa+H2↑ | D. | 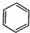 +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$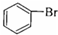 +HBr +HBr |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
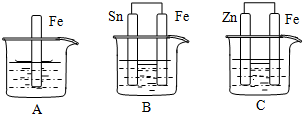
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,22.4L氫氣和氧氣的混合氣體,所含分子數(shù)為NA | |
| B. | 常溫常壓下,1mol氦氣含有的原子數(shù)為2NA | |
| C. | 1molAl3+含有核外電子數(shù)為10NA | |
| D. | 17gNH3含有的電子數(shù)為10NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
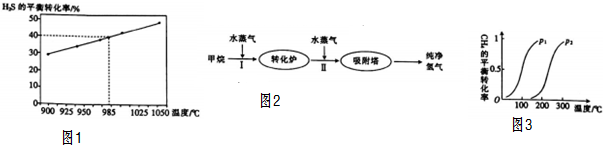
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
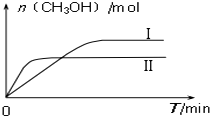 研究和深度開發(fā)CO、CO2的應用對構建生態(tài)文明社會具有重要的意義.
研究和深度開發(fā)CO、CO2的應用對構建生態(tài)文明社會具有重要的意義.| 容 器 | 甲 | 乙 |
| 反應物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 第n周期的最后一種金屬元素處在第n主族(n>1) | |
| B. | m=1與m=7的元素單質相互化合時,都能形成離子化合物 | |
| C. | 第n周期有8-n種非金屬元素(n>1,包括稀有氣體元素) | |
| D. | m-n=5的主族元素存在本周期最強的對應含氧酸 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題

查看答案和解析>>
湖北省互聯(lián)網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com