
氮及其化合物在工農業生產、生活中有著重要作用。
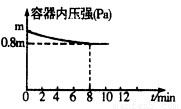
(1)在T℃時,將0.6molH2和0.4molN2置于容積為2 L的密閉容器中(壓強為mPa)發生反應:3H2+N2 2NH3? △H<0。若保持溫度不變,某興趣小組同學測得反應過程中容器內壓強隨時間變化如圖所示:8 min內分鐘NH3的平均生成速率為??? mol·L-1·min-1。
2NH3? △H<0。若保持溫度不變,某興趣小組同學測得反應過程中容器內壓強隨時間變化如圖所示:8 min內分鐘NH3的平均生成速率為??? mol·L-1·min-1。
(2)仍在T℃時,將0.6molH2和0.4molN2置于一容積可變的密閉容 器中。
①下列各項能說明該反應已達到平衡狀態的是?????? (填序號)。
a.容器內N2、H2、NH3的濃度之比為l:3:2
b.3v正(N2)=v逆(H2)
c.3v正(H2)=2v逆(NH3)
d.混合氣體的密度保持不變
e.容器中氣體的平均相對分子質量不隨時間而變化
②該條件下達到平衡時NH3的體積分數與題(1)條件下NH3的體積分數相比 ??????? (填“變大”“變小”或“不變”)。
③達到平衡后,改變某一條件使反應速率發生了如圖所示的變化,改 變的條件可能是????????? 。
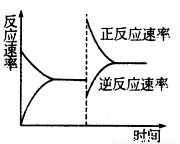
a.升高溫度,同時加壓
b.降低溫度,同時減壓
c.保持溫度、壓強不變,增大反應物濃度
d.保持溫度、壓強不變,減小生成物濃度
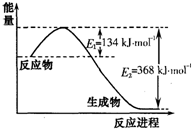
(3)硝酸廠的尾氣含有氮氧化物,不經處理直接排放將污染空氣。??? 氨氣能將氮氧化物還原為氮氣和水,其反應機理為:
2NH3(g)+5NO2(g)=7NO(g)+3H2O(g)??  H=-akJ·mol-1
H=-akJ·mol-1
4NH3(g)+6NO(g)=5N2(g)+6H2O(g)?  H=-bkJ·mol-1
H=-bkJ·mol-1
則NH3直接將NO2還原為N2的熱化學方程式為:?????????????? 。
若標準狀況下NO與NO2混合氣體40.32L被足量氨水完全吸收,產生標準狀況下氮氣42.56L。該混合氣體中NO與NO2的體積之比為??????? 。
(1)0.0125;(2)①bde;②變大;③c;
(3)8NH3(g)+6NO2(g)=7N2(g)+12H2O(g)?? △H=—(6a+7b)/5kJ·mol-1;1:2。
【解析】
試題分析:(1)分析題給圖像知,反應體系中的壓強由起始狀態的m變為平衡狀態的0.8m,根據阿伏加德羅定律:在等溫等容的條件下,氣體的壓強之比等于氣體的物質的量之比知,容器內氣體的總物質的量為反應前的1.0mol變為平衡后的0.8mol,氣體的物質的量減少0.2mol;結合反應3H2+N2 2NH3 利用差量法分析知,生成氣體減少的物質的量與生產氨氣的物質的量的相等,為0.2mol,根據公式v=△n/V△t計算得8 min內分鐘NH3的平均生成速率為0.0125mol·L-1·min-1;(2)① a.平衡時N2、H2、NH3的濃度之比不一定為l:3:2,錯誤;b.由3v正(N2)=v逆(H2)得v正(N2):v逆(H2)=1:3,等于化學計量數之比,正確;c.由3v正(H2)=2v逆(NH3)得v正(H2):v逆(NH3)=2:3,不等于化學計量數之比,錯誤;d.由于反應在容積可變的密閉容器中進行,混合氣體的密度隨反應的進行不斷變化,當其保持不變時已達平衡,正確;e.容器中氣體的平均相對分子質量不隨時間而變化,已達平衡,正確,選bde;②合成氨的反應正向為氣體物質的量減小的反應,等溫等壓條件下達到平衡與等溫等容條件下達到平衡相比,相當于縮小容器的體積,平衡正向移動,NH3的體積分數變大;③a.升高溫度,同時加壓,v正、v逆同時增大,與圖像不符,錯誤;b.降低溫度,同時減壓,v正、v逆同時減小,與圖像不符,錯誤;c.保持溫度、壓強不變,向容器內充入氮氣或氫氣來增大反應物濃度,v正增大,容器內氣體物質的量增大,為保持壓強不變,容器體積增大,氨氣濃度減小,v逆減小,達平衡后速率可能比原平衡大,正確;d.保持溫度、壓強不變,從容器內分離出氨氣來減小生成物濃度,v逆減小,容器內氣體物質的量減小,為保持壓強不變,容器體積減小,反應物濃度增大,v正增大,根據等效平衡知識知,達平衡后速率與原平衡相等,與圖像不符,錯誤,選c;(3)根據反應① 2NH3(g)+5NO2(g)=7NO(g)+3H2O(g)?? △H=-akJ·mol-1
2NH3 利用差量法分析知,生成氣體減少的物質的量與生產氨氣的物質的量的相等,為0.2mol,根據公式v=△n/V△t計算得8 min內分鐘NH3的平均生成速率為0.0125mol·L-1·min-1;(2)① a.平衡時N2、H2、NH3的濃度之比不一定為l:3:2,錯誤;b.由3v正(N2)=v逆(H2)得v正(N2):v逆(H2)=1:3,等于化學計量數之比,正確;c.由3v正(H2)=2v逆(NH3)得v正(H2):v逆(NH3)=2:3,不等于化學計量數之比,錯誤;d.由于反應在容積可變的密閉容器中進行,混合氣體的密度隨反應的進行不斷變化,當其保持不變時已達平衡,正確;e.容器中氣體的平均相對分子質量不隨時間而變化,已達平衡,正確,選bde;②合成氨的反應正向為氣體物質的量減小的反應,等溫等壓條件下達到平衡與等溫等容條件下達到平衡相比,相當于縮小容器的體積,平衡正向移動,NH3的體積分數變大;③a.升高溫度,同時加壓,v正、v逆同時增大,與圖像不符,錯誤;b.降低溫度,同時減壓,v正、v逆同時減小,與圖像不符,錯誤;c.保持溫度、壓強不變,向容器內充入氮氣或氫氣來增大反應物濃度,v正增大,容器內氣體物質的量增大,為保持壓強不變,容器體積增大,氨氣濃度減小,v逆減小,達平衡后速率可能比原平衡大,正確;d.保持溫度、壓強不變,從容器內分離出氨氣來減小生成物濃度,v逆減小,容器內氣體物質的量減小,為保持壓強不變,容器體積減小,反應物濃度增大,v正增大,根據等效平衡知識知,達平衡后速率與原平衡相等,與圖像不符,錯誤,選c;(3)根據反應① 2NH3(g)+5NO2(g)=7NO(g)+3H2O(g)?? △H=-akJ·mol-1
②4NH3(g)+6NO(g)=5N2(g)+6H2O(g)? △H=-bkJ·mol-1利用蓋斯定律:(①×6+②×7)÷5得NH3直接將NO2還原為N2的熱化學方程式為:③8NH3(g)+6NO2(g)=7N2(g)+12H2O(g)?? △H=—(6a+7b)/5kJ·mol-1;根據反應②和③列方程組計算;設NO的物質的量為x,NO2的物質的量為y,根據題意知,x+y=40.32/22.4mol=1.8mol,5/6x+7/6y=42.56/22.4mol=1.9mol解得x=0.6mol,y=1.2mol;則該混合氣體中NO與NO2的體積之比為1:2。
考點:考查化學反應速率和化學平衡及相關圖像、蓋斯定律及根據化學方程式計算。


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:閱讀理解
 2NH3(g)
2NH3(g)| t/K | 298 | 398 | 498 | … |
| K/(mol?L-1)2 | 4.1×106 | K1 | K2 | … |
 [N2H5?H2O]++H+
[N2H5?H2O]++H+ [N2H5?H2O]++H+
[N2H5?H2O]++H+
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
| ||
| 高溫 |
| ||
| 高溫 |
| 4 |
| 7 |
| ||
| 高溫 |
| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
| 10-7y |
| x-y |
| 10-7y |
| x-y |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解

| ||
| (一定條件) |
 2NH3(g),△H<0,其化學平衡常數K與t的關系如下表:(已知K=
2NH3(g),△H<0,其化學平衡常數K與t的關系如下表:(已知K=| C(N2)?[C (H2) ]3 |
| [C (NH3)]2 |
| t/K | 298 | 398 | 498 | … |
| K/(mol?L-1)-2 | 4.1×106 | K1 | K2 | … |
查看答案和解析>>
科目:高中化學 來源: 題型:
 氮是地球上含量豐富的一種元素,氮及其化合物在工農業生產、生活中有著重要作用.請回答下列問題:
氮是地球上含量豐富的一種元素,氮及其化合物在工農業生產、生活中有著重要作用.請回答下列問題:| t/K | 298 | 398 | 498 | … |
| K/(mol?L-1)-2 | 4.1×106 | K1 | K2 | … |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com