
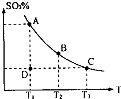
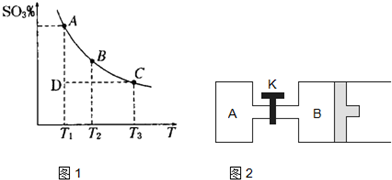
 (1)在硫酸生產中,SO2催化氧化生成SO3是反應的關鍵,其反應的化學方程式為:2SO2(g)+O2(g)?2SO2(g),反應混合體系SO3的百分含量和溫度的關系如圖所示(曲線上任何一點都表示平衡狀態),根據圖示回答下列問題:
(1)在硫酸生產中,SO2催化氧化生成SO3是反應的關鍵,其反應的化學方程式為:2SO2(g)+O2(g)?2SO2(g),反應混合體系SO3的百分含量和溫度的關系如圖所示(曲線上任何一點都表示平衡狀態),根據圖示回答下列問題:| Kw |
| Kw |
| 1 |
| 2 |
| x |
| 0.18 |
| 0.09mol |
| 5L?0.5min |
| Kw |


 優百分課時互動系列答案
優百分課時互動系列答案 開心蛙狀元作業系列答案
開心蛙狀元作業系列答案 課時掌控隨堂練習系列答案
課時掌控隨堂練習系列答案科目:高中化學 來源: 題型:閱讀理解
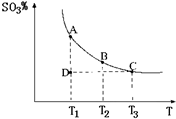 (2011?松江區模擬)運用化學反應原理研究氮、硫、氯、碘等單質及其化合物的反應有重要意義.
(2011?松江區模擬)運用化學反應原理研究氮、硫、氯、碘等單質及其化合物的反應有重要意義. 2SO3(g),混合體系中SO3的百分含量和溫度的關系如圖所示(曲線上任何一點都表示平衡狀態).根據圖示回答下列問題:
2SO3(g),混合體系中SO3的百分含量和溫度的關系如圖所示(曲線上任何一點都表示平衡狀態).根據圖示回答下列問題: 2SO3(g)是
2SO3(g)是
查看答案和解析>>
科目:高中化學 來源: 題型:
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 釩沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源:2012-2013學年陜西省西安市高三第一次質檢化學試卷(解析版) 題型:計算題
(1)在硫酸生產中,SO2催化氧化生成SO3是反應的關鍵,其反應的化學方程式為: ,反應混合體系SO3的百分含量和溫度的關系如圖所示(曲線上任何一點都表示平衡狀態),根據圖示回答下列問題:
,反應混合體系SO3的百分含量和溫度的關系如圖所示(曲線上任何一點都表示平衡狀態),根據圖示回答下列問題:

①反應 0(填“>”或“<”)。若在恒溫恒容條件下,上述反應達到平衡,再給該平衡體系中通入SO3氣體,容器內的壓強 (填“增大”、“減小”或“不變”),平衡 移動(填“向正反應方何”、“逆反應方向’或“不”)若在恒溫恒壓條件下,上述反應達到平衡,再給該平衡體系中通人大量氮氣后,體系重新達到平衡,此平衡與原平衡相比較,SO2的物質的量 __(填“增大”、“減小”或“不變”),O2的物質的量濃度
(填“增大”、“減小”或“不變”)。
0(填“>”或“<”)。若在恒溫恒容條件下,上述反應達到平衡,再給該平衡體系中通入SO3氣體,容器內的壓強 (填“增大”、“減小”或“不變”),平衡 移動(填“向正反應方何”、“逆反應方向’或“不”)若在恒溫恒壓條件下,上述反應達到平衡,再給該平衡體系中通人大量氮氣后,體系重新達到平衡,此平衡與原平衡相比較,SO2的物質的量 __(填“增大”、“減小”或“不變”),O2的物質的量濃度
(填“增大”、“減小”或“不變”)。
②若溫度為T1、 T2,反應的平衡常數分別為K1、K2 則K1 K2(填“>”、“<”或“=”),反應進行到D點狀態時,V正 V逆(填“>”、“<”或“=”)
③在一個固定容積為5L的密閉容器中充入0.20 mol SO2和0.10 mol O2,在500℃開始反應,半分鐘達到平衡,測得容器內含SO3 0.18 mol,則v(O2)= mol·L-1·min-1,若繼續通入0.20 mol SO2和0.10 mol O2,平衡發生了移動,再次達到平衡后, mol<n(SO3)< mol.
(2)已知三種無色溶液:a.NaHCO3溶液,b.AlCl3溶液,c.NaAlO2溶液,它們兩兩反應均能生成Al(OH)3沉淀。請回答下列問題:
①兩種溶液恰好完全反應,所得溶液中c(OH—)= 是水的離子積),則這兩種溶液可為 (填字母)。
是水的離子積),則這兩種溶液可為 (填字母)。
②能體現出NaHCO3在反應中,HCO—3的水解程度小于電離程度的離于方程式為 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com