
 ,B原子L層的電子總數是K層的3倍;0.1mol C單質能從酸中置換出2.24L氫氣(標準狀況),同時它的電子層結構變得與氖原子的電子層結構相同;D離子的半徑比C離子的小,D離子與B離子的電子層結構相同.
,B原子L層的電子總數是K層的3倍;0.1mol C單質能從酸中置換出2.24L氫氣(標準狀況),同時它的電子層結構變得與氖原子的電子層結構相同;D離子的半徑比C離子的小,D離子與B離子的電子層結構相同. .
.分析 B原子L層的電子總數是K層的3倍,B的原子原子核外各層電子數分別為2、6,則B為O元素;A的電子式為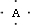 ,A和B在同一周期,則A為C元素;0.1molC單質能從酸中置換出2.24L氫氣(標準狀況),氫氣物質的量為0.1mol,則反應中C的化合價為$\frac{0.1mol×2}{0.1mol}$=+2,故C原子最外層有2個電子,離子的與氖原子的電子層結構相同,則C為Mg元素;D離子的半徑比C離子的小,D離子與B離子的電子層結構相同,D為Al元素,據此解答.
,A和B在同一周期,則A為C元素;0.1molC單質能從酸中置換出2.24L氫氣(標準狀況),氫氣物質的量為0.1mol,則反應中C的化合價為$\frac{0.1mol×2}{0.1mol}$=+2,故C原子最外層有2個電子,離子的與氖原子的電子層結構相同,則C為Mg元素;D離子的半徑比C離子的小,D離子與B離子的電子層結構相同,D為Al元素,據此解答.
解答 解:B原子L層的電子總數是K層的3倍,B的原子原子核外各層電子數分別為2、6,則B為O元素;A的電子式為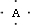 ,A和B在同一周期,則A為C元素;0.1molC單質能從酸中置換出2.24L氫氣(標準狀況),氫氣物質的量為0.1mol,則反應中C的化合價為$\frac{0.1mol×2}{0.1mol}$=+2,故C原子最外層有2個電子,離子的與氖原子的電子層結構相同,則C為Mg元素;D離子的半徑比C離子的小,D離子與B離子的電子層結構相同,D為Al元素.
,A和B在同一周期,則A為C元素;0.1molC單質能從酸中置換出2.24L氫氣(標準狀況),氫氣物質的量為0.1mol,則反應中C的化合價為$\frac{0.1mol×2}{0.1mol}$=+2,故C原子最外層有2個電子,離子的與氖原子的電子層結構相同,則C為Mg元素;D離子的半徑比C離子的小,D離子與B離子的電子層結構相同,D為Al元素.
(1)C為Mg元素,在周期表中的位置:第三周期第ⅡA族,
故答案為:第三周期第ⅡA族;
(2)A的氣態氫化物為CH4,用電子式表示形成過程: ,
,
故答案為: ;
;
(3)A的單質和B的單質充分反應生成化合物為CO2,結構式是O=C=O,
故答案為:O=C=O;
(4)四種元素中,最高價氧化物的水化物既能溶于酸,又能溶于堿,該物質為Al(OH)3,其溶于NaOH溶液的化學方程式為:Al(OH)3+NaOH=NaAlO2+2H2O,
故答案為:Al(OH)3+NaOH=NaAlO2+2H2O.
點評 本題考查元素位置結構性質關系及應用,題目難度中等,注意掌握用電子式表示化學鍵或物質的形成.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:選擇題
| A. | 碘元素在海水中沒有游離態存在 | |
| B. | 在提取的過程中用的氧化劑可以是H2O2 | |
| C. | 操作A是萃取 | |
| D. | B是提純操作,常用蒸餾 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題




查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 兩種粒子,若核外電子排布完全相同,則其化學性質一定相同 | |
| B. | 凡單原子形成的離子,一定具有稀有氣體元素原子的核外電子排布 | |
| C. | 兩原子,如果核外電子排布相同,則一定屬于同種元素 | |
| D. | 陰離子的核外電子排布一定與比它原子序數小的稀有氣體元素原子的核外電子排布相同 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 可逆反應N2(g)+3H2(g)?2NH3(g),正反應為放熱反應,在一密閉容器中進行,如圖是該過程中的反應速率(v)與時間(t)的關系曲線,下列敘述錯誤的是( )
可逆反應N2(g)+3H2(g)?2NH3(g),正反應為放熱反應,在一密閉容器中進行,如圖是該過程中的反應速率(v)與時間(t)的關系曲線,下列敘述錯誤的是( )| A. | t1~t2,各物質的濃度不再發生變化 | |
| B. | t2時刻升高溫度,反應物轉化率不會改變 | |
| C. | t2時刻增大N2的濃度,可提高H2的轉化率 | |
| D. | 使用催化劑可加快反應速率,提高生產效率 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2.3 g Na和足量的O2完全反應,生成3.4g固體混合物,轉移電子數為0.1NA | |
| B. | 電解精煉銅時,當陽極減少64g金屬時轉移的電子數為2NA | |
| C. | 46 g的NO2與46 g的N2O4含有的原子數不同 | |
| D. | 標準狀況下,11.2 L苯中含有碳碳雙鍵數目為3NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com