
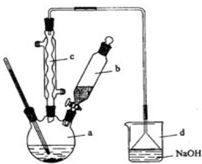
 溴苯是一種化工原料,實驗室合成溴苯的裝置示意圖及有關數據如表:
溴苯是一種化工原料,實驗室合成溴苯的裝置示意圖及有關數據如表:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸點/°C | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
分析 (1)苯與液溴反應生成HBr,HBr與水蒸氣結合呈白霧;HBr與液溴易揮發,而苯的鹵代反應是放熱的,尾氣中有HBr及揮發出的Br2,用氫氧化鈉溶液吸收,防止污染大氣;
(2)溴苯中含有溴,加NaOH溶液,把未反應的Br2變成NaBr和NaBrO洗到水中,然后加干燥劑,據此解答;
(3)反應后得到的溴苯中溶有少量苯雜質,依據它和溴苯的性質不同除雜;
(4)根據制取溴苯所加的液體的體積進行解答;
(5)根據題意,a中有鐵粉、液溴和苯,鐵和溴 反應生成溴化鐵,在溴化鐵作催化劑的條件下,溴與苯反應生成溴苯.
解答 解:(1)苯與液溴反應生成HBr,HBr與水蒸氣結合呈白霧;HBr與液溴都易揮發,而苯的鹵代反應是放熱的,尾氣中有HBr及揮發出的Br2,用氫氧化鈉溶液吸收,防止污染大氣,
故答案為:HBr;吸收HBr和Br2;
(2)②溴苯提純的方法是:先水洗,把可溶物溶解在水中,然后過濾除去未反應的鐵屑,再加NaOH溶液,把未反應的Br2變成NaBr和NaBrO洗到水中.
故答案為:除去HBr和未反應的Br2;
③向分出的粗溴苯中加入少量的無水氯化鈣,靜置、過濾.加入氯化鈣的目的是,無水氯化鈣能干燥溴苯,
故答案為:干燥;
(3)反應后得到的溴苯中溶有少量未反應的苯,苯和溴苯互溶,但苯的沸點低,所以采用蒸餾的方法進行分離,溴苯留在母液中,
故答案為:苯;C;
(4)操作過程中,在a中加入12mL無水苯,向a中加入10mL水,在b中小心加入8.0mL液態溴,所以a的容積最適合的是50mL,
故答案為:B;
(5)根據題意,a中有鐵粉、液溴和苯,鐵和溴 反應生成溴化鐵,在溴化鐵作催化劑的條件下,溴與苯反應生成溴苯,反應的方程式為2Fe+3Br2=2FeBr3、C6H6+Br2$\stackrel{FeBr_{3}}{→}$ C6H5Br+HBr,
故答案為:2Fe+3Br2=2FeBr3、C6H6+Br2$\stackrel{FeBr_{3}}{→}$C6H5Br+HBr;
點評 本題考查物質制備實驗及產率的計算,為高頻考點,明確實驗原理是解本題關鍵,知道實驗操作步驟及基本操作方法,題目難度中等.


 新課標階梯閱讀訓練系列答案
新課標階梯閱讀訓練系列答案 口算心算速算應用題系列答案
口算心算速算應用題系列答案 同步拓展閱讀系列答案
同步拓展閱讀系列答案科目:高中化學 來源: 題型:選擇題
| A. | 在含有NA個CH3COO-的醋酸溶液中,H+數目略大于NA | |
| B. | 1molCl2和足量氫氧化鈉溶液充分反應,轉移電子數目為2NA | |
| C. | 電解精煉銅時,若轉移了NA個電子,則陽極質量減小32g | |
| D. | 標況下,11.2LSO3所含的分子數目為0.5NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
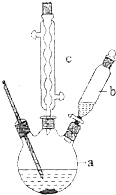 苯乙酸是有機合成的中間產物,下面是它的一種實驗室合成路線:
苯乙酸是有機合成的中間產物,下面是它的一種實驗室合成路線: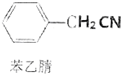 +H2O+H2SO4$\stackrel{100~130℃}{→}$
+H2O+H2SO4$\stackrel{100~130℃}{→}$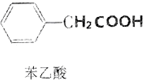 +NH4HSO4
+NH4HSO4查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 時間t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.2 | 0.2 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
 “低碳經濟”已成為科學家研究的主要課題之一.
“低碳經濟”已成為科學家研究的主要課題之一.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 加熱后在空氣中冷卻稱量固體 | B. | 晶體中含有加熱易揮發的雜質 | ||
| C. | 實驗所取晶體已有部分脫水 | D. | 晶體加熱時脫水不完全 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com