
【題目】乙醇是重要的有機化工原料,可由乙烯水合法生產,反應的化學方程式如下:C2H4(g) + H2O(g) ![]() C2H5OH(g) ,下圖為乙烯的平衡轉化率與溫度(T)、壓強(P)的關系[起始n(C2H4) : n(H2O) =1:1]。
C2H5OH(g) ,下圖為乙烯的平衡轉化率與溫度(T)、壓強(P)的關系[起始n(C2H4) : n(H2O) =1:1]。

下列有關敘述正確的是
A. Y對應的乙醇的物質的量分數為![]()
B. X、Y、Z對應的反應速率:υ(X) >υ(Y) >υ(Z)
C. X、Y、Z對應的平衡常數數值:KX < KY <KZ
D. 增大壓強、升高溫度均可提高乙烯的平衡轉化率
【答案】A
【解析】A. 據圖可知,Y點對應乙烯的平衡轉化率為20%,起始n(C2H4) : n(H2O) =1:1,設C2H4和H2O的起始物質的量均為1mol,根據三段式法有:
C2H4(g) + H2O(g) ![]() C2H5OH(g)
C2H5OH(g)
起始(mol) 1 1 0
轉化(mol) 0.2 0.2 0.2
平衡(mol) 0.8 0.8 0.2
則平衡時乙醇的物質的量分數為: ![]() =
=![]() ,故A正確;B. 因該反應是氣體體積減小的可逆反應,所以壓強越大,乙烯的平衡轉化率越大,則結合圖象可得:P1<P2<P3,且X、Y、Z三點對應的溫度越來越高,所以X、Y、Z對應的反應速率:υ(X) <υ(Y) <υ(Z),故B錯誤;C. 據圖可知,升高溫度,乙烯的平衡轉化率降低,說明該反應為放熱反應,升高溫度平衡逆向移動,平衡常數減小,則X、Y、Z對應的平衡常數數值:KX > KY >KZ,故C錯誤;D. 因該反應是氣體體積減小的可逆反應,則壓強越大,乙烯的平衡轉化率越大,又因該反應是放熱反應,升高溫度平衡逆向移動,乙烯的平衡轉化率降低,故D錯誤;答案選A。
,故A正確;B. 因該反應是氣體體積減小的可逆反應,所以壓強越大,乙烯的平衡轉化率越大,則結合圖象可得:P1<P2<P3,且X、Y、Z三點對應的溫度越來越高,所以X、Y、Z對應的反應速率:υ(X) <υ(Y) <υ(Z),故B錯誤;C. 據圖可知,升高溫度,乙烯的平衡轉化率降低,說明該反應為放熱反應,升高溫度平衡逆向移動,平衡常數減小,則X、Y、Z對應的平衡常數數值:KX > KY >KZ,故C錯誤;D. 因該反應是氣體體積減小的可逆反應,則壓強越大,乙烯的平衡轉化率越大,又因該反應是放熱反應,升高溫度平衡逆向移動,乙烯的平衡轉化率降低,故D錯誤;答案選A。


 課堂全解字詞句段篇章系列答案
課堂全解字詞句段篇章系列答案 步步高口算題卡系列答案
步步高口算題卡系列答案 點睛新教材全能解讀系列答案
點睛新教材全能解讀系列答案科目:高中化學 來源: 題型:
【題目】下列說法中正確的是
A.標準狀況下,1mol水的體積是22.4LB.1mol任何氣體,體積均為22.4L
C.1molO2在標準狀況下的體積約為22.4LD.標準狀況下,氣體的摩爾體積是22.4L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖裝置制取溴苯,回答下列問題:
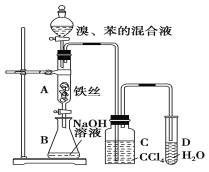
(1)寫出A中反應的化學方程式:_______________________;
(2)C中盛放CCl4的作用是___________________________;
(3)D中加入硝酸銀溶液,實驗后溶液中能看到的實驗現象為_____________________;
(4)常用于鑒別苯和甲苯的試劑為_________________;
(5)E物質分子式為C8H10,且苯環上的一氯代物只有一種,則E的名稱為_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】乙烷(C2H6)作為一種新能源在化學領域應用廣泛,請回答下列問題:(如圖所示,裝置Ⅰ為乙烷燃料電池(電解質溶液為KOH溶液),通過裝置Ⅱ實現鐵棒上鍍銅。
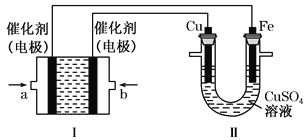
①a處應通入______(填“C2H6”或“O2”),a處電極上發生的電極反應式是____________________________________;
②電鍍結束后,裝置Ⅰ中溶液的pH______(填寫“變大”“變小”或“不變”,下同),裝置Ⅱ中Cu2+的物質的量濃度______;
③電鍍結束后,裝置Ⅰ溶液中的陰離子除了OH-以外還含有___________(忽略水解);在此過程中若完全反應,裝置Ⅱ中陰極質量變化12.8 g,則裝置Ⅰ中理論上消耗乙烷________L(標準狀況下)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】T K時,向2.0 L恒容密閉容器中充入0.10 mol COCl2,發生反應COCl2(g)![]() Cl2(g)+CO(g),經過一段時間后反應達到平衡。反應過程中測得的部分數據見下表:
Cl2(g)+CO(g),經過一段時間后反應達到平衡。反應過程中測得的部分數據見下表:
t/s | 0 | 2 | 4 | 6 | 8 |
n(Cl2)/mol | 0 | 0.030 | 0.039 | 0.040 | 0.040 |
下列說法正確的是( )
A. 保持其他條件不變,升高溫度,平衡時c(Cl2)=0.038 mol·L-1,則反應的ΔH<0
B. 反應在前2 s的平均速率v(CO)=0.015 mol·L-1·s-1
C. 保持其他條件不變,起始時向容器中充入0.12 mol COCl2、0.06 mol Cl2和0.06 mol CO,反應達到平衡前的速率:v正<v逆
D. 保持其他條件不變,起始時向容器中充入0.10 mol Cl2和0.08 mol CO,達到平衡時,Cl2的轉化率大于60%
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各組物質按酸、堿、鹽分類順次排列.正確的是( )
A.硫酸、純堿、碳酸鈣
B.硝酸、燒堿、食鹽
C.冰醋酸、純堿、醋酸鈉
D.鹽酸、熟石灰、苛性鈉
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】分子式為C7H16、C5H11Cl、C5H10(鏈狀,不考慮空間構型)的同分異構體的數目分別有( )種
A. 9,8,5 B. 8,9,5 C. 9,9,6 D. 8,8,6
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A.氯氣能將單質鐵還原為氯化鐵
B.鹽酸既有氧化性又有還原性
C.氫氣在氯氣中劇烈燃燒,火焰呈蒼白色,有白煙生成
D.為測定新制氯水的pH,用玻璃棒蘸取液體滴在pH試紙上,與標準比色卡對照即可
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某工廠廢水中含游離態氯,通過下列實驗測定其濃度。
①取水樣10.0ml于錐形瓶中,加入10.0ml的KI溶液(足量),發生的反應為:Cl2+2KI=2KCl+I2,滴入指示劑2~3滴。
②②取一滴定管依次用自來水、蒸餾水洗凈后,再用0.01mol·L-1Na2S2O3溶液潤洗,然后裝入0.01mol·L-1Na2S2O3溶液到0刻度以上,排出下端尖嘴內的氣泡,調整液面至0刻度或0刻度下某一位置,記下讀數。
③將錐形瓶置于滴定管下進行滴定,發生的反應為:I2+2Na2S2O3=2NaI+ 2Na2S4O6 試回答下列問答:
(1)步驟①加入的指示劑是_______________________________。
(2)步驟②應使用________式滴定管。
(3)判斷達到滴定終點的實驗現象是___________________________________;
(4)用0.1032mol/L HCl溶液滴定未知濃度的NaOH溶液,下列情況對實驗結果無影響的是____________
A.酸式滴定管未用標準鹽酸溶液潤洗
B.錐形瓶未用待測液潤洗
C.滴定前滴定管尖嘴中有一氣泡,滴定后氣泡消失了
D.滴定時將標準液濺出錐形瓶外
(5)碳酸H2CO3,K1=4.3×10-7,K2=5.6×10-11,草酸H2C2O4,K1=5.9×10-2,K2=6.4×10-50.1 mol/L Na2CO3溶液的pH____________0.1 mol/L Na2C2O4溶液的pH。(選填“大于”、“小于”或“等于”)。若將等濃度的草酸溶液和碳酸溶液等體積混合,溶液中各種離子濃度大小的順序正確的是_____________。(選填編號)
A.c(H+)>c(HC2O4-)>c[HCO3-)>c[CO32-) B.c(HCO3-)>c(HC2O4-)>c(C2O42-)>c(CO32-)
C.c(H+)>c(HC2O4-)>c(C2O42-)>c(CO32-) D.c(H2CO3) >c(HCO3-)>c(HC2O4-)>c(CO32-)
(6)已知:①難溶電解質的溶度積常數:Ksp(CaF2)=1.5×10-10 ②25℃時,2.0×10-3mol·L-1氫氟酸水溶液中,調節溶液pH(忽略體積變化),得到c(HF)、c(F-)與溶液pH的變化關系,如下圖所示:請根據以下信息回答下列問題:
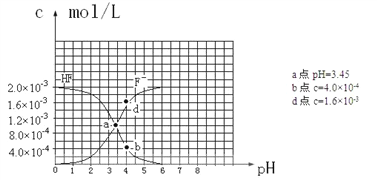
①25℃時,HF電離平衡常數的數值Ka≈_______________________________。
②4.0×10-3 mol·L-1HF溶液與4.0×10-4 mol·L-1 CaCl2溶液等體積混合,調節混合液pH為4.0(忽略調節混合液體積的變化),通過列式計算說明是否有沉淀產生。_______________________________________
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com