
下列說法正確的是
A. 第2周期元素從左到右,最高正化合價從+1遞增到+7
B. 在周期表中的過渡元素中尋找半導體材料
C. 元素周期表中元素的性質與元素在周期表中的位置有關
D. 同種元素的原子均有相同的質子數和中子數
科目:高中化學 來源:2017屆河北省張家口市高三第一學期期末教學質量監測化學試卷(解析版) 題型:簡答題
乙苯(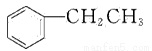 )在有機合成中占有重要的地位,有著廣泛的用途。
)在有機合成中占有重要的地位,有著廣泛的用途。
已知:
①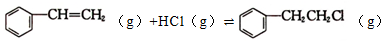 ΔH1=-54kJ·mol-1。
ΔH1=-54kJ·mol-1。
②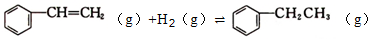 ΔH2=-121kJ·mol-1。
ΔH2=-121kJ·mol-1。
③H2(g)+Cl2(g)=2HCl(g) ΔH3=-185kJ·mol-1。
④相關化學鍵的鍵能數據如表所示。
化學鍵 | C—H | C—C | C=C | C—Cl | H—Cl |
鍵能/(kJ·mol-1) | 412 | 348 | x | 341 | 432 |
請回答:
(1)根據化學反應原理,縮小容器容積對反應②的影響為________。
(2)根據反應①和表中數據計算,x=________。
(3)
①ΔH4=________。
②該反應正、逆反應平衡常數與溫度的關系如圖所示,其中表示正反應平衡常數K正的曲線為________(填“A”或“B”),理由為________。
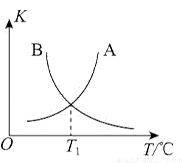
④T1℃時,該反應的平衡常數K=________。該溫度下,起始向容積為10L的容積可變的密閉容器中充入1mol (g)、2molCl2(g)、1mol
(g)、2molCl2(g)、1mol (g)、2molHCl(g),則開始時,v正________(填“>”“<”或“=”)v逆。
(g)、2molHCl(g),則開始時,v正________(填“>”“<”或“=”)v逆。
查看答案和解析>>
科目:高中化學 來源:2016-2017學年江西省南昌市、洪都中學、麻丘中學、十七中、桑海中學高二3月聯考化學試卷(解析版) 題型:選擇題
在核磁共振氫譜中出現兩組峰,其氫原子數之比為3:2的化合物( )
A. 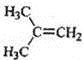
B. 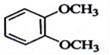
C. 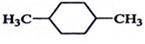
D. 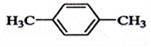
查看答案和解析>>
科目:高中化學 來源:2016-2017學年山東省棗莊市北校區高一下學期第一次月考化學試卷(解析版) 題型:選擇題
短周期元素X、Y、Z、W、Q在元素周期表中的相對位置如下圖所示,下列說法正確的是
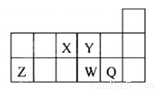
A. 離子Y2-和Z3+的核外電子數和電子層數都不相同
B. 原子半徑的大小順序為rX>rY>rZ>rW>rQ
C. 元素X與元素Z的最高正化合價之和的數值等于8
D. 元素W的最高價氧化物對應的水化物的酸性比Q的強
查看答案和解析>>
科目:高中化學 來源:2016-2017學年山東省棗莊市北校區高一下學期第一次月考化學試卷(解析版) 題型:選擇題
某元素X的氣態氫化物的化學式為XH3,則下列敘述中不正確的是
A. 該元素原子的最外電子層上有5個電子
B. 該元素最高價氧化物的化學式為X2O5
C. 該元素在元素周期表中位于VA族
D. 該元素最高價氧化物對應的水化物的化學式為H2XO3
查看答案和解析>>
科目:高中化學 來源:2016-2017學年山東省棗莊市北校區高一下學期第一次月考化學試卷(解析版) 題型:選擇題
下列說 法正確的是
法正確的是
A.SiH4比CH4穩定
B.O2-半徑比F-的小
C.Na和Cs屬于第IA族元素,Cs失電子能力比Na強
D.P和As屬于第VA族元素,H3PO4酸性比H3AsO4弱
查看答案和解析>>
科目:高中化學 來源:2016-2017學年山東省棗莊市北校區高一下學期第一次月考化學試卷(解析版) 題型:選擇題
我國稀土資源豐富。下列有關稀土元素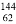 Sm與
Sm與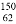 Sm的說法正確的是
Sm的說法正確的是
A. 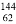 Sm與
Sm與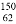 Sm互為同位素 B.
Sm互為同位素 B. 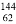 Sm與
Sm與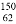 Sm的化學性質不同
Sm的化學性質不同
C. 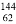 Sm與
Sm與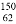 Sm是同一種核素 D.
Sm是同一種核素 D. 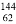 Sm與
Sm與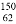 Sm的核外電子數和中子數均為62
Sm的核外電子數和中子數均為62
查看答案和解析>>
科目:高中化學 來源:2017屆內蒙古赤峰市寧城縣高三一模理科綜合化學試卷(解析版) 題型:簡答題
工業廢水中常含有一定量Cr2O72-和CrO42-,它們會對人類及生態系統產生很大傷害。
已知:i. 2CrO42-(黃色)+ 2H+  Cr2O72-(橙色)+ H2O
Cr2O72-(橙色)+ H2O
ii. Cr(OH)3(s) + H2O  [Cr(OH)4]- (亮綠色) + H+
[Cr(OH)4]- (亮綠色) + H+
(1) 含鉻工業廢水的一種處理流程如下:

① i. 若在轉化一步中調節溶液的pH=2,則溶液顯_______色。
ii. 能說明轉化一步反應達平衡狀態的是_______(填字母序號)。
a.Cr2O72-和CrO42-的濃度相同 b.ν正(Cr2O72-) = 2ν逆(CrO42-)
c.溶液的顏色不變 d.溶液的pH不變
② 步驟②還原一步的離子方程式是___________________________;若還原l mol Cr2O72-離子,需要FeSO4·7H2O的物質的量是_______mol。
③ 沉淀一步中,向含Cr3+(紫色)溶液中,逐漸滴加NaOH溶液。當pH=4.6時,開始出現灰綠色沉淀,隨著pH的升高,沉淀量增多。當pH≥13時,沉淀逐漸消失,溶液變為亮綠色。
i. 請解釋溶液逐漸變為亮綠色的原因:_______。
ii. 若向0.05mol·L-1的Cr2(SO4)3溶液50mL中,一次性加入等體積0.6 mol·L-1的NaOH溶液,充分反應后,溶液中可觀察到的現象是__________。
④ 在K[Cr(OH)4]和K2Cr2O7混合溶液中加入足量H2SO4酸化,鉻元素以_______形式存在(填離子符號)。
(2) 用Fe做電極電解含Cr2O72-的酸性工業廢水,可以直接除去鉻。隨著電解進行,在陰極附近溶液pH升高,產生Cr(OH)3沉淀。
① 結合上述工業流程分析用Fe做電極的原因:_______。
② 結合電極反應式解釋在陰極附近溶液pH升高的原因:_______。
③ 溶液中同時生成的沉淀可能還有_______(填化學式)。
查看答案和解析>>
科目:高中化學 來源:2016-2017學年山東省棗莊市南校區高一3月月考化學試卷(解析版) 題型:推斷題
A、B、C、D、E、F六種短周期主族元素,原子序數依次增大。其中B的單質在常溫下為雙原子分子,它與A的單質可形成分子X,X的水溶液呈堿性;D的簡單陽離子與X具有相同電子數,且D是同周期中簡單離子半徑最小的元素;E元素的原子最外層比次外層少兩個電子,C、F兩種元素的原子最外層共有13個電子。則
(l)這六種元素分別為A_____、B_____、C _____、D_____、E_____、F_____(填元素名稱)。
(2)E的離子結構示意圖_____;X的電子式_____;
(3)B、C、E分別與A形成的化合物中最穩定的是_____(寫化學式);
(4)DF3所含化學鍵類型_____、DF3與過量的強堿反應的離子反應方程式__________;
(5)F的單質在反應中常作_____劑,該單質的水溶液與E的低價氧化物反應的離子方程式為_________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com