煤化工中常需研究不同溫度下平衡常數、投料比及熱值等問題.已知下列兩個反應的熱效應及平衡常數:
反應①:C(s)+H
2O(g)=CO(g)+H
2(g)
△H1=akJ?mol-1,平衡常數為K
1;
反應②:C(s)+CO
2(g)=2CO(g)
△H2=bkJ?mo1-1,平衡常數為K
2;
又知反應CO(g)+H
2O(g)=CO
2(g)+H
2(g)的平衡常數Kc隨溫度的變化如下表:
| 溫度/ |
400 |
500 |
800 |
| 平衡常數Kc |
9.94 |
9 |
1 |
回答下列問題:
(1)上述反應中,a
b(填>、<或=),化學平衡常數Kc與K
1、K
2的關系為
.
(2)溫度為800℃時,在一體積為10L的密閉容器中,通入一定量的CO和H
2O (g),發生如下反應:CO(g)+H
2O(g)=CO
2(g)+H
2(g),容器內各物質的濃度變化如下表.
800℃時物質的量濃度(mol?L
-1)的變化
| 時間(min) |
CO(g) |
H2O(g) |
CO2(g) |
H2(g) |
| 0 |
0.200 |
0.300 |
0 |
0 |
| 2 |
0.120 |
0.220 |
0.080 |
0.080 |
| 3 |
0.080 |
0.180 |
0.120 |
0.120 |
| 4 |
0.100 |
0.200 |
0.100 |
C1 |
| 5 |
0.067 |
0.267 |
0.133 |
C2 |
①表中0~2min的平均反應速率v(CO)=
.
②表中第3min反應處于
狀態(填“平衡”或“非平衡”);
③表中3min~4min之間,平衡向
移動(單選),可能的原因是
(單選);
表中4min~5min之間數值發生變化,可能的原因是
(單選).
a.正反應方向 b.逆反應方向 c.增加水蒸氣
d.降低溫度 e.使用催化劑 f.增加氫氣濃度

(3)如圖1、圖2表示反應CO(g)+H
2O(g)=CO
2(g)+H
2(g)在t
1時刻達到平衡,在t
2時刻因改變某個條件而發生變化的情況:
①圖1中時刻t
2發生改變的條件是
,
②圖2中時刻t
2發生改變的條件是
.




 名校課堂系列答案
名校課堂系列答案 H2(g)+CO2(g)的平衡常數隨溫度的變化如表:
H2(g)+CO2(g)的平衡常數隨溫度的變化如表: 2CO(g)平衡常數K;
2CO(g)平衡常數K; CO(g)+H2(g) 平衡常數K1;
CO(g)+H2(g) 平衡常數K1; H2(g)+CO2(g) 平衡常數K2,
H2(g)+CO2(g) 平衡常數K2,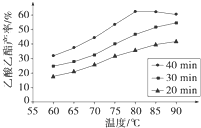 Ⅰ工業上常利用醋酸和乙醇合成有機溶劑乙酸乙酯:CH3COOH(l)+C2H5OH(l)
Ⅰ工業上常利用醋酸和乙醇合成有機溶劑乙酸乙酯:CH3COOH(l)+C2H5OH(l)