
【題目】25℃時,部分物質的電離平衡常數如表所示:
化學式 | CH3COOH | H2CO3 | HClO |
電離平衡常數 | 1.7×10﹣4molL﹣1 | K1=4.4×10﹣6molL﹣1 K2=5.6×10﹣11molL﹣1 | 3.0×10﹣8 molL﹣1 |
請回答下列問題:
(1)同濃度的CH3COOH、H2CO3、HClO溶液的pH最大的是_____.
(2)常溫下0.1molL﹣1的CH3COOH溶液在加水稀釋過程中,下列表達式的數據一定變小的是_____(填字母序號,下同).
A.c(H+)
B.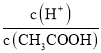
C.c(H+)c(OH﹣)
D.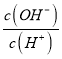
E.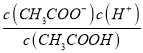
若該溶液升高溫度,上述5種表達式的數據增大的是_________.
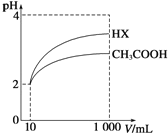
(3)體積為10mL pH=2的醋酸溶液與一元酸HX溶液分別加水稀釋至1000mL,稀釋過程pH變化如圖:則HX的電離平衡常數_____(填“大于”、“等于”或“小于”)醋酸的平衡常數.稀釋后,HX溶液中有水電離出來的c(H+)_____(填“大于”、“等于”或“小于”)醋酸的溶液中有水電離出來的c(H+),理由是___________.
(4)已知100℃時,水的離子積為1×10﹣12,該溫度下測得某溶液PH=7,該溶液顯_____(填“酸”、“堿”或“中”)性.將此溫度下PH=1的H2SO4溶液aL與PH=11的NaOH溶液bL混合,若所得混合液PH=2,則a:b=_____.
【答案】HClO A ABCE 大于 大于 HX酸性強于CH3COOH的,稀釋后HX溶液中的c(H+)小于CH3COOH溶液中的c(H+),所以其對水電離的抑制能力也較弱 堿 11:9
【解析】
結合表中數據,可知酸性CH3COOH、H2CO3、HClO、HCO3-依次減弱。
(1)CH3COOH、H2CO3、HClO酸性依次減弱,故同濃度的CH3COOH、H2CO3、HClO溶液的pH最大的是HClO;
(2)A、0.1mol/L的CH3COOH溶液加稀釋過程中,溶液中氫離子濃度減小,所以A選項是正確的;
B、0.1mol/L的CH3COOH溶液加稀釋過程中,各個微粒濃度減小,同時醋酸的電離向右移動, c(H+)減小的程度小于CH3COOH的減小程度,所以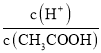 增大,故B錯誤;
增大,故B錯誤;
C、![]() 只受溫度的影響,溫度不變則其值是一個常數,故C錯誤;
只受溫度的影響,溫度不變則其值是一個常數,故C錯誤;
D、醋酸稀釋,酸性減弱, c(H+)減小,水的離子積不變,則c(OH-)增大,所以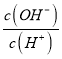 增大,故D錯誤;
增大,故D錯誤;
E、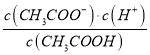 為醋酸的電離平衡常數,因為溫度不變,則水的電離平衡常數不變,故E錯誤;
為醋酸的電離平衡常數,因為溫度不變,則水的電離平衡常數不變,故E錯誤;
因此,本題正確答案是:A;
若該溶液升高溫度,醋酸、水的電離程度對增大,則溶液中氫離子、氫氧根離子濃度都增大,
A.升高溫度后溶液中氫離子濃度c(H+)增大,所以A選項是正確的;
B.升高溫度后氫離子、氫氧根離子濃度都增大, 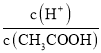 ,醋酸的濃度減小,則該比值增大,所以B選項是正確的;
,醋酸的濃度減小,則該比值增大,所以B選項是正確的;
C. c(H+)c(OH﹣)為水的離子積,升高溫度后水的電離程度增大,則水的離子積增大,所以C選項是正確的;
D.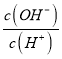 升高溫度后氫氧根離子、氫離子濃度都增大,但氫離子濃度增大的幅度大于氫氧根離子,所以該比值減小,故D錯誤;
升高溫度后氫氧根離子、氫離子濃度都增大,但氫離子濃度增大的幅度大于氫氧根離子,所以該比值減小,故D錯誤;
E.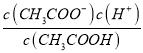 為醋酸的電離平衡常數,升高溫度后產生的電離平衡常數增大,故E正確;
為醋酸的電離平衡常數,升高溫度后產生的電離平衡常數增大,故E正確;
因此,本題正確答案是:ABCE.
(3)根據圖象分析知道,起始是兩種溶液中c(H+)相同,c(較弱酸)>c(較強酸),稀釋過程中較弱酸的電離程度增大,故在整個稀釋過程中較弱酸的c(H+)一直大于較強酸的c(H+),稀釋相同倍數,HX的pH變化比CH3COOH的大,故HX酸性強,電離平衡常數大;HX酸性強于CH3COOH的,稀釋后HX溶液中c(H+)小于CH3COOH溶液中的c(H+),所以對水的抑制能力減弱;
(4)100℃時,水的離子積為![]() ,
,![]() ,pH=6,為中性溶液,該溫度下測得某溶液pH=7,該溶液顯堿性,將此溫度下pH=1的
,pH=6,為中性溶液,該溫度下測得某溶液pH=7,該溶液顯堿性,將此溫度下pH=1的![]() 溶液aL與pH=11的NaOH溶液bL混合,若所得混合液pH=2說明溶液顯酸性,
溶液aL與pH=11的NaOH溶液bL混合,若所得混合液pH=2說明溶液顯酸性,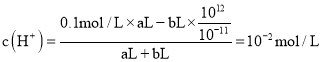 , a:b=11:9。
, a:b=11:9。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】有機物種類繁多,請以你對有機物的認識填空:
(1)下列幾組物質中,互為同位素的是__,互為同素異形體的是__,互為同系物的是___,互為同分異構體的是___。
①O2和O3;②35Cl和37Cl;③CH3CH3和CH3CH2CH3;④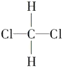 和
和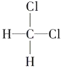 ;⑤CH3(CH2)2CH3和(CH3)2CHCH3;⑥
;⑤CH3(CH2)2CH3和(CH3)2CHCH3;⑥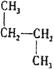 和
和![]() ;⑦
;⑦![]() 和CH3(CH2)3CH3;
和CH3(CH2)3CH3;
(2)下列各烷烴的沸點由高到低的順序為___(用字母表示)
A.正戊烷 B.異戊烷 C.CH3(CH2)2CH3 D.新戊烷 E.C3H8
(3)聚乙烯可用于制造食品包裝袋,由乙烯制備聚乙烯的化學方程式為___。
(4)丙烯中處于同一平面的原子最多有___個,丙烯使溴水褪色,其化學方程式為___,該反應的類型是___。
(5)1mol某烷烴完全燃燒時消耗氧氣的物質的量為11mol,其化學式為___,其結構中含有3個-CH3的結構簡式分別為:___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度下在密閉容器中發生如下可逆反應:2M(g)+N(g)![]() 2E(g),若開始時只充入2mol E(g),達平衡時,E的轉化率為40%;若開始時充入2mol M和1mol N的混合氣體,達平衡時混合氣體的壓強比起始時減少了( )
2E(g),若開始時只充入2mol E(g),達平衡時,E的轉化率為40%;若開始時充入2mol M和1mol N的混合氣體,達平衡時混合氣體的壓強比起始時減少了( )
A.20%B.40%C.60%D.80%
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鐵碳微電解技術是利用原電池原理處理酸性污水的一種工藝,裝置如圖。若上端開口關閉,可得到強還原性的H· (氫原子);若上端開口打開,并鼓入空氣,可得到強氧化性的·OH (羥基自由基)。下列說法錯誤的是( )。
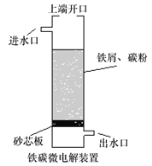
A.無論是否鼓入空氣,負極的電極反應式均為Fe-2e-=Fe2+
B.不鼓入空氣時,正極的電極反應式為H++e-= H·
C.鼓入空氣時,每生成1mol·OH有2mol電子發生轉移
D.處理含有草酸(H2C2O4)的污水時,上端開口不需要應打開
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上回收利用某合金廢料(主要含Fe、Cu、Co、Li等,已知Co、Fe都是中等活潑金屬)的工藝流程如下:
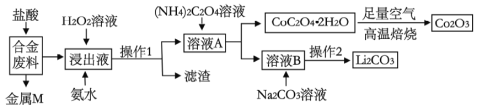
(1)合金廢料中加入鹽酸浸取,此處鹽酸不能換為硝酸,原因是_______________。
(2)操作1用到的玻璃儀器有__________________________。
(3)浸出液中加入H2O2溶液和氨水,應先加入_____________,加入氨水發生反應的離子方程式為____________________。
(4)在空氣中焙燒CoC2O4·2H2O的化學方程式是____________________。
(5)已知Li2CO3微溶于水,其飽和溶液的濃度與溫度關系見下表
溫度/℃ | 10 | 30 | 60 | 90 |
濃度/molL-1 | 0.21 | 0.17 | 0.14 | 0.10 |
則操作2的具體流程是_______________、_____________、洗滌、干燥。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】釩的化合物常用于制催化劑和新型電池。回答下列問題:
(1) V2O5為黃褐色固體,無味、有毒,微溶于水,是許多反應的催化劑。25℃時,部分含釩微粒的存在形式、濃度及存在的pH范圍之間的變化關系如圖所示(其余可溶性微粒均未標出),圖中“[V]”表示含釩微粒的濃度,虛線表示[V]或pH的范圍尚未確定。
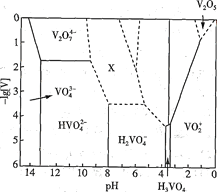
①V2O5溶于足量1.0 mol·L-1NaOH溶液中,發生反應的離子方程式為_____________________
②上述滴加H2SO4溶液的過程中,先后發生如下反應:

則“X所示區域的離子”不可能是____________(填標號)。
A.V3O93- B.V4 O103- C.V4 O124-
(2)如圖所示為可充電的全釩液流電池構造示意圖,該電池中的隔膜只允許H+通過。電池放電時,負極區溶液的pH將_________ (填“增大”“減小”或“不變”),電池充電時,陽極的電極反應式為_______________________________________。
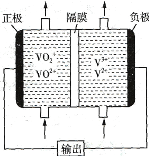
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室以蛇紋石酸浸出液(主要含Fe3+,還有一定量的Al3+、Mn2+、Ca2+、Mg2+等)為原料制備高純氧化鐵,流程如下:

已知流程中相關金屬離子生成氫氧化物沉淀的pH如下表:
氫氧化物 | Fe3+ | Fe2+ | Al3+ |
開始沉淀的pH | 1.1 | 5.8 | 3.0 |
沉淀完全的pH | 3.2 | 8.8 | 5.0 |
(1)“還原”時,應選擇_____________(填字母)。
A.Zn粉 B.NaClO溶液 C.Fe粉
(2)“濾渣”的主要成分除含有少量MnF2外,還含有_____________(填化學式)。
(3)“沉錳”時,已知:Ksp(MnS)=4.65×10–14。為確保沉錳完全[即溶液中c(Mn2+)<1.0×10–6 mol·L1],應保持溶液中c(S2-)>_____________mol·L-1。
(4)“除鋁”時,控制溶液pH的范圍為_____________。
(5)“氧化”時,常用酸性K2Cr2O7溶液檢測是否殘留未被氧化的金屬離子,該反應的離子方程式為_____________。
(6)“沉鐵”時,反應溫度為85℃條件下,反應時間和反應終點pH對鐵的沉淀率的影響分別如下圖所示,則最佳的工藝條件是_____________。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某無色溶液中可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 這幾種離子中的若干種,依次進行下列實驗,觀察到的現象記錄如下:①
這幾種離子中的若干種,依次進行下列實驗,觀察到的現象記錄如下:①![]() 試紙檢驗,溶液的
試紙檢驗,溶液的![]() ②取少量原溶液,向溶液中加入過量的
②取少量原溶液,向溶液中加入過量的![]() 和鹽酸的混合溶液,無白色沉淀生成③另取少量原溶液,向溶液中滴加足量氯水、無氣體產生,再加入
和鹽酸的混合溶液,無白色沉淀生成③另取少量原溶液,向溶液中滴加足量氯水、無氣體產生,再加入![]() 振蕩,靜置后
振蕩,靜置后![]() 層呈橙色,用分液漏斗分液④向分液后的水溶液中加入
層呈橙色,用分液漏斗分液④向分液后的水溶液中加入![]() 和
和![]() 溶液,有白色沉淀產生⑤在濾液中加入
溶液,有白色沉淀產生⑤在濾液中加入![]() 和
和![]() 的混合溶液有白色沉淀產生。則關于原溶液的判斷中正確的是
的混合溶液有白色沉淀產生。則關于原溶液的判斷中正確的是
A.肯定不存在的離子是![]() 、
、![]() 、
、![]() 、
、![]()
B.肯定存在的離子是![]() 、
、![]() 、
、![]()
C.無法確定原溶液中是否存在![]() 和
和![]()
D.若步驟④改用![]() 和鹽酸的混合溶液,則對溶液中離子的判斷也無影響
和鹽酸的混合溶液,則對溶液中離子的判斷也無影響
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com