
| A. | 硫化亞鐵溶于稀硝酸中:FeS+2 H+═Fe2++H2S↑ | |
| B. | NH4HCO3溶于過量NaOH溶液中:HCO3-+OH-═CO32-+H2O | |
| C. | 少量二氧化碳通入苯酚鈉溶液中:C6H5O-+CO2+H2O═C6H5OH+CO32- | |
| D. | 大理石溶于醋酸中:CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O |
分析 A.硫化亞鐵具有還原性,而硝酸具有氧化性,兩者要發生氧化還原反應;
B.NH4HCO3溶于過量NaOH溶液中生成碳酸鈉和氨氣;
C.少量二氧化碳通入苯酚鈉溶液中生成苯酚和碳酸氫鈉;
D.大理石不溶于水,醋酸為弱酸,應寫成化學式,二者反應生成醋酸鈣、水和二氧化碳.
解答 解:A.硫化亞鐵具有還原性,而硝酸具有氧化性,兩者要發生氧化還原反應,正確的離子反應為FeS+4H++NO3-=Fe3++S↓+NO↑+2H2O,故A錯誤;
B.NH4HCO3溶于過量NaOH溶液中生成碳酸鈉和氨氣,反應的離子方程式為NH4++HCO3-+2OH-═CO32-+2H2O+NH3↑,故B錯誤;
C.向苯酚鈉溶液中通入少量CO2氣體生成苯酚和碳酸氫鈉,反應的離子方程式為C6H5O-+CO2+H2O═C6H5OH+HCO3-,故C錯誤;
D.大理石不溶于水,醋酸為弱酸,應寫成化學式,二者反應生成醋酸鈣、水和二氧化碳,反應的離子方程式為CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O,故D正確.
故選D.
點評 本題考查了離子方程式的判斷,為中等難度的試題,注意掌握離子方程式的書寫原則,明確離子方程式正誤判斷常用方法:檢查反應物、生成物是否正確,檢查各物質拆分是否正確,如難溶物、弱電解質等需要保留化學式,檢查是否符合原化學方程式等.


 輕巧奪冠周測月考直通名校系列答案
輕巧奪冠周測月考直通名校系列答案科目:高中化學 來源: 題型:解答題

| 烷烴 | 烯烴 | 芳香烴 | 鹵代烴 | 醇 | 醛 | 羧酸 | 脂肪烴 |
| ①③ | ⑤ | ⑥ | ④ | ②⑦ | ⑨ | ⑧ | ①③⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 石墨比金剛石穩定 | |
| B. | 金剛石比石墨穩定 | |
| C. | 1mol石墨比1 mol金剛石的總能量高 | |
| D. | 1mol石墨比1 mol金剛石的總能量低 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 滴定終點時俯視讀數 | |
| B. | 滴定前滴定管尖嘴中有一氣泡,滴定后氣泡消失了 | |
| C. | 錐形瓶未用待測液潤洗 | |
| D. | 滴定前,滴定管中的溶液液面最低點未定在“0”點 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
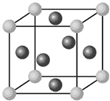 氯化鉻酰(CrO2Cl2)在有機合成中可作氧化劑或氯化劑,能與許多有機物反應.請回答下列問題:
氯化鉻酰(CrO2Cl2)在有機合成中可作氧化劑或氯化劑,能與許多有機物反應.請回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 實驗目的 | 實驗操作 | |
| A | 驗證乙烯能被酸性高錳酸鉀溶液氧化 | 將乙醇與濃硫酸反應生成的氣體通往酸性高錳酸鉀溶液,觀察溶液是否褪色 |
| B | 檢驗淀粉水解產物的還原性 | 取少量淀粉溶液,與稀硫酸共熱后再加入銀氨溶液,水浴加熱,觀察是否出現銀鏡 |
| C | 檢驗溴乙烷中的溴元素 | 取少量溴乙烷,與氫氧化鈉溶液共熱后加入硝酸銀溶液,觀察是否出現淺黃色沉淀 |
| D | 證明溴乙烷發生消去反應有乙烯生成 | 向試管中加入適量的溴乙烷和NaOH的乙醇溶液,加熱,將反應產生的氣體先通過盛有水的洗氣瓶再通入酸性高錳酸鉀溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
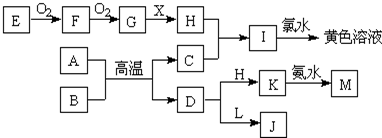
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com