
(本題共12分)
我國利用生產磷銨[(NH4)3PO4]排放的廢渣磷灰石制取硫酸并聯產水泥的技術研究獲得成功。已知磷灰石的主要成分是Ca3(PO4)2,具體生產磷銨流程如下:
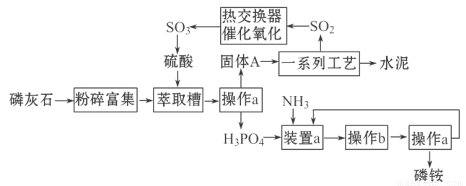
38.操作a的名稱是___________,實驗室中進行此操作的非玻璃儀器用品有___________;在實驗室中操作b的名稱是______________________。
39.裝置a中生成兩種酸式鹽,它們的化學式分別是_______________________。
40.固體A中一定含有的物質,其化學式是_________________。
41.熱交換器是實現冷熱交換的裝置。化學實驗中也經常利用熱交換來實現某種實驗目的,氣、液熱交換時通常使用的儀器是________________________。
42. 制硫酸所產生的尾氣除了含有N2、O2外,還含有SO2,微量的SO3和酸霧。能用于測定硫酸尾氣中SO2含量的試劑是__________。
a.NaOH溶液、酚酞試液 b.KMnO4溶液、稀硫酸
c. 碘水、淀粉溶液 d.氨水、酚酞試液
所用的測量方法為 。
38. 過濾 (1分) 鐵架臺(含鐵圈)、濾紙 (1分) 蒸發濃縮、冷卻結晶(2分)
39. NH4H2PO4、(NH4)2HPO4 (2分)
40. CaSO4·2H2O (2分)
41. 冷凝管 (1分)
42. b、c (2分) (氧化還原)滴定法(1分)
【解析】
試題分析:38.固液分離用過濾操作,操作中用到漏斗、玻璃棒、燒杯和鐵架臺、濾紙等;從濾液中得到晶體應采用蒸發濃縮、冷卻結晶的方法,銨鹽穩定性差,不宜采用蒸發結晶;39.磷酸為三元酸,生成兩種酸式鹽;40.磷酸鈣與硫酸反應生成磷酸和硫酸鈣,故A中一定含有硫酸鈣晶體;42.利用SO2的還原性采用滴定法測定其含量,可以用氧化劑酸性KMnO4溶液、碘水等氧化。
考點:考查工業流程中物質的制備、分離、分析等有關問題。


 舉一反三單元同步過關卷系列答案
舉一反三單元同步過關卷系列答案科目:高中化學 來源:2013-2014云南省高二下學期第二次月考化學試卷(解析版) 題型:選擇題
常溫時,下列敘述正確的是
A. pH=9的NH4Cl與NH3?H2O混合溶液中c(Cl-)>c(NH4+)
B. pH=2.5的可樂中c(H+) 是pH=3.5的檸檬水中c(H+)的10倍
C. AgCl在0.1mol /L CaCl2溶液和0.1mol/L NaCl溶液中的溶解度相同
D. 1 mL 1mol /L Na2CO3溶液加水稀釋至100mL, pH和Kw均減小
查看答案和解析>>
科目:高中化學 來源:2013-2014云南省高一下學期期末考試化學試卷(解析版) 題型:選擇題
使1mol乙烯與氯氣發生完全加成反應,然后使該加成反應的產物與氯氣在光照的條件下發生取代反應,則兩個過程中消耗的氯氣的總的物質的量是
A.3mol B.4mol C.5mol D.6mol
查看答案和解析>>
科目:高中化學 來源:2013-2014云南省昭通市畢業生復習統一檢測理科綜合化學試卷(解析版) 題型:填空題
(14分)

明礬[KAl(SO4)2·12H2O] 在生產、生活中有廣泛用途:飲用水的凈化;造紙工業上作施膠劑;食品工業的發酵劑等。利用煉鋁廠的廢料——鋁灰(含Al 、 Al2O3及少量SiO2和FeO ·xFe2O3)可制備明礬。工藝流程如下:
回答下列問題:
(1)明礬凈水的原理是(用離子方程表示)
(2)操作Ⅰ是 ,操作Ⅱ是蒸發濃縮、 、過濾、 干燥。
(3)檢驗濾液A中是否存在Fe2+的方法是 (只用一種試劑)
(4)在濾液A中加入高錳酸鉀的目的是 ,發生反應的離子方程式為(該條件下Fe2+ 轉化為Fe3+,MnO4- 轉化為Mn2+) 。
已知:生成氫氧化物沉淀的pH如下表所示
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
開始沉淀時 | 3.4 | 6.3 | 1.5 |
完全沉淀時 | 4.7 | 8.3 | 2.8 |
注:金屬離子的起始濃度為0.1 mol·L-1
根據表中數據解釋調pH=3的目的 。
(5)己知:在pH=3、加熱條件下,MnO4- 可與Mn2+反應生成MnO2。加入MnSO4發生反應的離子方程式為: 。濾渣2含有的物質是 。
(6)以Al和NiO(OH)為電極,KOH溶液為電解液可組成新型、高效電池,充放電過程中,發生Ni(OH)2與NiO(OH)之間的轉化,寫出放電時電池反應的化學方程式 。
查看答案和解析>>
科目:高中化學 來源:2013-2014云南省昭通市畢業生復習統一檢測理科綜合化學試卷(解析版) 題型:選擇題
某有機物的結構簡式如圖所示,下列關于該物質的性質描述正確的是

A.不能使溴的四氯化碳溶液褪色
B.能發生縮聚反應
C.既能發生消去反應,也能發生取代反應
D.1 mol該物質最多可與5mol NaOH反應
查看答案和解析>>
科目:高中化學 來源:2013-2014上海市黃浦區高三二模化學試卷(解析版) 題型:選擇題
實驗室中配制碘水,往往是將I2溶于KI溶液中,即可得到濃度較大的碘水,原因是發生了反應:I2(aq)+I-(aq) I3-(aq)。在反應的平衡體系中,c(I3-)與溫度T的關系如圖所示(曲線上的任何一點都表示平衡狀態)。
I3-(aq)。在反應的平衡體系中,c(I3-)與溫度T的關系如圖所示(曲線上的任何一點都表示平衡狀態)。

下列說法正確的是
A.該反應的正反應為放熱反應
B.A狀態與C狀態的化學反應速率大小為v(A)>v(C)
C.D狀態時,v正>v逆
D.欲配制濃度較大的氯水,可將氯氣通入氯化鉀溶液中
查看答案和解析>>
科目:高中化學 來源:2013-2014上海市黃浦區高三二模化學試卷(解析版) 題型:選擇題
有4種金屬a、b、c、d,它們與濃HNO3反應時,只有a不反應;往這4種金屬粉末的混合物中加入鹽酸,其中b、c溶解,過濾后,在濾液中加入過量的NaOH溶液,可得到c離子的沉淀,則這4種金屬的活動性強弱的順序可能是
A.c > b > d > a B.b > a > d > c C.a > b > c > d D.d > c > b > a
查看答案和解析>>
科目:高中化學 來源:2013-2014上海市靜安區第二學期高二學業水平測試化學試卷(解析版) 題型:實驗題
硫代硫酸鈉的純度可用滴定法進行測定,原理是:2S2O32-+ I2 → S4O62-+ 2I-
38. 配制100 mL0.0500 mol/L I2溶液,不需要的儀器是 (選填編號)。
a.100 mL容量瓶 b.量筒 c.燒杯 d.玻璃棒
滴定管標有使用溫度:20oC; 滴定管的最小刻度為 mL。
39.取2 .500g含雜質的Na2S2O3·5H2O晶體配成50mL溶液,每次取10.00mL放入錐形瓶里,加2滴淀粉為指示劑,再用0.0500 mol/L I2溶液滴定,實驗數據如下(第3次初讀數為 0.00,終點讀數如圖; 雜質不參加反應):

編號 | 1 | 2 | 3 |
消耗I2溶液的體積/mL | 19.98 | 20.02 |
|
到達滴定終點的現象是 ;
Na2S2O3?5H2O(式量248)的質量分數是(保留4位小數) 。
40.會造成實驗結果偏低的操作是 (選填編號)。
a. 滴定時滴定管中的液體滴在錐形瓶外
b. 錐形瓶用蒸餾水洗凈后,立即裝入待測溶液
c. 未用標準液潤洗滴定管
d. 振蕩時溶液濺出錐形瓶外
查看答案和解析>>
科目:高中化學 來源:2013-2014上海市寶山區高二年級化學學科質量監測化學試卷(解析版) 題型:選擇題
在100mL0.1mol/L醋酸溶液中加入以下物質中的一種,醋酸溶液pH變小。所加入的這種物質是
A.水 B. 0.1mol/L鹽酸
C. 醋酸鈉晶體 D. 0.1mol/L氫氧化鈉溶液
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com