
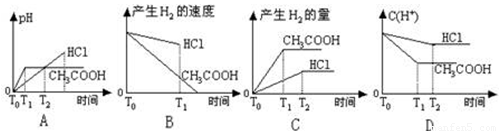
在體積都為1L,pH都等于2的鹽酸和醋酸溶液中,投入0.65g鋅粒,則下圖所示比較符合客觀事實的是
C
【解析】
試題分析:0.65g鋅的物質的量=0.65g÷65g/mol=0.01mol,需要鹽酸和醋酸的物質的量都是0.02mol。鹽酸是強酸,醋酸是弱酸,在pH都是2的情況下鹽酸的濃度是0.01mol/L,而醋酸的濃度大于0.01mol/L。溶液的體積都是1L,因此鹽酸的物質的量是0.01mol,醋酸的物質的量大于0.01mol。所以與0.65g鋅反應時鹽酸不足,醋酸過量,即醋酸產生的氫氣多。在反應過程中醋酸還可以繼續電離出氫離子,所以醋酸的反應速率快,因此C正確。A、起始時溶液的pH=2,而不是0,A不正確;B、產生氫氣的速率醋酸快,B不正確;D、在反應過程中醋酸溶液中氫離子濃度大于鹽酸溶液中氫離子濃度,D不正確,答案選C。
考點:考查鹽酸、醋酸與鋅的反應的有關判斷、計算以及圖像分析


 期末集結號系列答案
期末集結號系列答案科目:高中化學 來源:2013屆黑龍江省高二上學期期末考試化學試卷 題型:選擇題
在體積都為1L、pH都等于2的鹽酸和醋酸溶液中,投入0.65g鋅粒,則下列各圖所示內容比較符合客觀事實的是

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com