
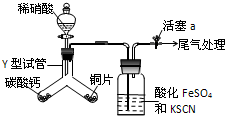
 (1)為探究銅與稀硝酸反應的氣態產物中是否含NO2,進行如下實驗.
(1)為探究銅與稀硝酸反應的氣態產物中是否含NO2,進行如下實驗.分析 (2)根據壓強差進行裝置氣密性的檢驗;
(3)實驗開始時先將Y形試管向盛有碳酸鈣的支管傾斜,緩慢滴入稀硝酸,碳酸鈣與稀硝酸生成CO2,將整個裝置內的空氣趕盡,避免NO和O2反應生成NO2對氣體產物的觀察產生干擾;在常溫下,銅片和稀硝酸反應生成硝酸銅、一氧化氮和水;
(4)本實驗生成的氣體中,若有NO2,NO2溶于水生成硝酸,把Fe2+氧化成Fe3+,B瓶溶液出現血紅色;用NaOH吸收尾氣.
解答 解:(2)根據壓強差進行裝置氣密性的檢驗,具體方法為:關閉活塞a和分液漏斗活塞,向分液漏斗中加水,打開分液漏斗活塞,水滴入圓底燒瓶一會兒后不再滴入,則裝置氣密性良好;
故答案為:關閉活塞a和分液漏斗活塞,向分液漏斗中加水,打開分液漏斗活塞,水滴入圓底燒瓶一會兒后不再滴入,則裝置氣密性良好;
(3)實驗開始時先將Y形試管向盛有碳酸鈣的支管傾斜,緩慢滴入稀硝酸,碳酸鈣與稀硝酸生成CO2,將整個裝置內的空氣趕盡,避免NO和O2反應生成NO2對氣體產物的觀察產生干擾;在常溫下,銅片和稀硝酸反應生成硝酸銅、一氧化氮和水,化學方程式為3Cu+8HNO3(稀)=3Cu (NO3)2+2NO↑+4H2O;
故答案為:利用生成的CO2將整個裝置內的空氣趕盡,避免NO和O2反應生成NO2對氣體產物的觀察產生干擾;3Cu+8HNO3(稀)=3Cu (NO3)2+2NO↑+4H2O;
(4)本實驗生成的氣體中,若有NO2,NO2溶于水生成硝酸,把Fe2+氧化成Fe3+,B瓶溶液出現血紅色;若無二氧化氮則無血紅色;常用堿液吸收NO尾氣,方程式為2NO+O2+2NaOH→NaNO2+NaNO3+H2O;
故答案為:檢驗有無NO2產生,若有NO2,則NO2與水反應生成硝酸,硝酸將Fe2+氧化為Fe3+,Fe3+與SCN-反應溶液呈血紅色,若無二氧化氮則無血紅色;2NO+O2+2NaOH→NaNO2+NaNO3+H2O.
點評 本題考查了銅和硝酸的反應實驗,探究銅與稀硝酸反應的產物及影響反應速率的主要因素,對比、對照分析是解題的關鍵.


 作業輔導系列答案
作業輔導系列答案科目:高中化學 來源: 題型:選擇題
| A. | (CH3)2CHCH2CH2CH3 | B. | (CH3)3CCH2CH3 | C. | (CH3)2CHCH(CH3)2 | D. | (CH3CH2)2CHCH3 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
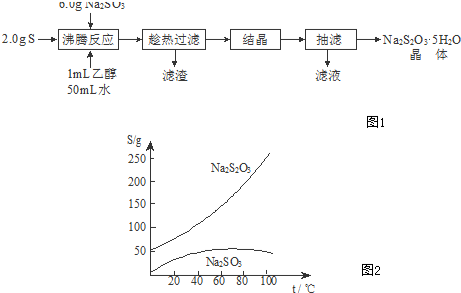
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
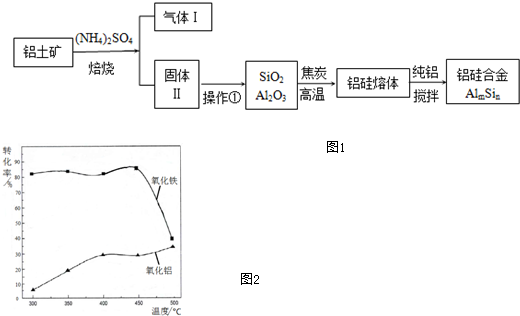
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
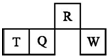 短周期元素R、T、Q、W在元素周期表中的相對位置如圖所示,其中T所處的周期序數與族序數相等.下列判斷不正確的是( )
短周期元素R、T、Q、W在元素周期表中的相對位置如圖所示,其中T所處的周期序數與族序數相等.下列判斷不正確的是( )| A. | 最簡單氣態氫化物的熱穩定性:R>Q | |
| B. | 最高價氧化物對應水化物的酸性:Q<W | |
| C. | 原子半徑:T>Q>R | |
| D. | T的最高價氧化物對應的水化物不能和強堿反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 從HF、HCl、HBr、HI酸性遞增的事實,推出F、Cl、Br、I的非金屬性遞增的 | |
| B. | Na在氧氣中燃燒主要生成Na2O | |
| C. | 第3周期非金屬元素含氧酸的酸性從左到右依次增強 | |
| D. | 元素周期律是元素原子核外電子排布周期性變化的結果 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 檢驗SO42-:加入BaCl2溶液出現白色沉淀,再加足量稀HCl沉淀不溶解 | |
| B. | 檢驗Cl-:確定無SO42-后,加入AgNO3溶液出現白色沉淀,加入足量稀HNO3沉淀不溶解 | |
| C. | 檢驗Na+:將干凈的鉑絲蘸取少量溶液在酒精燈上灼燒,觀察火焰呈黃色 | |
| D. | 檢驗NH4+:滴入NaOH溶液后,加熱,用濕潤藍色石蕊試紙檢驗發現變紅 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com