
【題目】在恒溫恒容的密閉容器中通入一定量的A、B,發生反應A(g)+2B(g)![]() 3C(g)。如圖是A的反應速率v(A)隨時間變化的示意圖。下列說法正確的是
3C(g)。如圖是A的反應速率v(A)隨時間變化的示意圖。下列說法正確的是
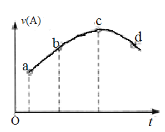
A. 反應物A的濃度:a點小于b點
B. A的平均反應速率:ab段大于bc段
C. 曲線上的c、d兩點都表示達到平衡狀態
D. 該反應的生成物可能對反應起催化作用
 新題型全程檢測期末沖刺100分系列答案
新題型全程檢測期末沖刺100分系列答案科目:高中化學 來源: 題型:
【題目】如圖是某興趣小組的探究性實驗圖示,有關說法合理的是( )
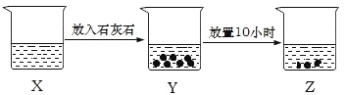
A. 若X中溶液為FeCl2溶液,則Z中最終可生成Fe(OH)2沉淀
B. 若X中溶液為新制的飽和氯水,則燒杯中液體的漂白性:X>Y>Z
C. 若X中溶液為NH4Cl溶液,則燒杯中液體的pH:X>Z
D. 若X中溶液為AlCl3溶液,可通過丁達爾現象證明 Z 中是否存在Al(OH)3膠體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】“封管實驗”具有簡易、方便、節約、綠色等優點,下列關于四個“封管實驗”![]() 夾持裝置未畫出、
夾持裝置未畫出、![]() 固體易升華
固體易升華![]() 的說法正確的是
的說法正確的是
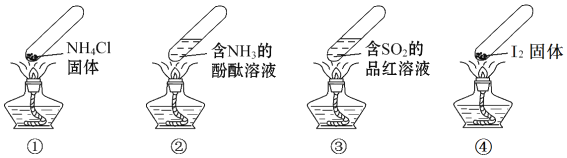
A. 加熱時,![]() 中封管內固體消失
中封管內固體消失
B. 加熱時,![]() 中溶液變紅,冷卻后又變為無色
中溶液變紅,冷卻后又變為無色
C. 加熱時,![]() 中溶液變紅,冷卻后紅色褪去,體現
中溶液變紅,冷卻后紅色褪去,體現![]() 的漂白性
的漂白性
D. 加熱又冷卻的過程中,![]() 屬于物理變化,
屬于物理變化,![]() 屬于化學變化
屬于化學變化
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某硫原子的質量是ag,12C原子的質量是bg,若NA只表示阿伏加德羅常數的數值,則下列說法中正確的是( )
①該硫原子的相對原子質量為![]() ②mg該硫原子的物質的量為
②mg該硫原子的物質的量為![]() mol
mol
③該硫原子的摩爾質量是aNA g ④ag該硫原子所含的電子數為16NA
A. ①③ B. ②④ C. ①② D. ②③
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮、硫、氯及其化合物是中學化學重要的組成部分。
(1)氨氣燃料電池使用的電解質溶液是KOH溶液,電池反應為:4NH3+3O2=2N2+6H2O。該電池負極的電極反應式為__________;用該電池進行粗銅(含Al、Zn、Ag、Pt、Au等雜質)的電解精煉,以CuSO4溶液為電解質溶液,下列說法正確的是________。
a.電能全部轉化為化學能
b.SO42﹣的物質的量濃度不變(不考慮溶液體積變化)
c.溶液中Cu2+向陽極移動
d.利用陽極泥可回收Ag、Pt、Au等金屬
e.若陽極質量減少64g,則轉移電子數為2NA個
(2)①將SO2通入到BaCl2溶液中,出現了異常現象,看到了明顯的白色沉淀,為探究該白色沉淀的成分,他設計了如下實驗流程:所得懸濁液![]() 白色沉淀
白色沉淀![]() 觀察現象并判斷,則試劑A的化學式為_________。實驗表明,加入試劑A后,白色沉淀未見溶解,產生該白色沉淀的離子方程式是________。
觀察現象并判斷,則試劑A的化學式為_________。實驗表明,加入試劑A后,白色沉淀未見溶解,產生該白色沉淀的離子方程式是________。
②利用如圖所示電化學裝置吸收工業尾氣中SO2,陰極上生成Cu。寫出裝置中陽極的電極反應式_________。
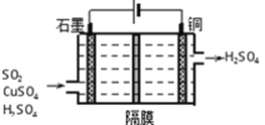
(3)已知Ksp(BaSO4)=1.0×10﹣10,Ksp(BaCO3)=2.5×10-9。某同學設想用下列流程得到BaCl2,BaSO4![]() BaSO3
BaSO3![]() BaCl2。則①的離子方程式為________,該反應的平衡常數K=_________。
BaCl2。則①的離子方程式為________,該反應的平衡常數K=_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】科學家尋找高效催化劑,通過如下反應實現大氣污染物轉化:
(1)NH3作為一種重要化工原料,被大量應用于工業生產,與其有關性質反應的催化劑研究曾被列入國家863計劃。在恒溫恒容裝置中充入一定量的NH3和O2,在某催化劑的作用下進行反應4NH3(g)+5O2(g) ![]() 4NO(g) +6H2O(g) △H<0,測得不同時間的NH3和O2的濃度如下表:
4NO(g) +6H2O(g) △H<0,測得不同時間的NH3和O2的濃度如下表:
時間(min) | 0 | 5 | 10 | 15 | 20 | 25 |
c(NH3)/mol·L-1 | 1.00 | 0.36 | 0.12 | 0.08 | 0. 0072 | 0.0072 |
c(O2)/mol·L-1 | 2.00 | 1.20 | 0.90 | 0.85 | 0.84 | 0.84 |
①前10分鐘內的平均速率v(NO)=___________________mol·L-1·min-1
②下列有關敘述中正確的是______________
A.使用催化劑時,可降低該反應的活化能,加快其反應速率
B.若測得容器內4v正(NH3)=6v逆(H2O)時,說明反應已達平衡
C.當容器內氣體的密度不變時,說明反應已達平衡
D.若該反應的平衡常數K值變大,在平衡移動過程中正反應速率先增大后減小
(2)氨催化氧化時會發生下述兩個競爭反應I、II。催化劑常具有較強的選擇性,即專一性。
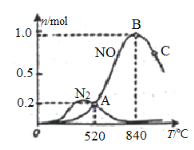
已知:反應I 4NH3(g)+5O2(g) ![]() 4NO(g) +6H2O(g) △H<0
4NO(g) +6H2O(g) △H<0
反應 II:4NH3(g)+3O2(g) ![]() 2N2(g) +6H2O(g) △H<0
2N2(g) +6H2O(g) △H<0
為分析某催化劑對該反應的選擇性,在1L密閉容器中充入1 mol NH3
①該催化劑在高溫時選擇反應____________ (填“ I ”或“ II”)。
②反應I的活化能Ea(正)________ Ea(逆) (填“小于”“等于”或“大于”)。
③520℃時,4NH3(g)+5O2![]() 4NO(g)+6H2O(g)的平衡常數K=________________ (不要求得出計算結果,只需列出數字計算式)。
4NO(g)+6H2O(g)的平衡常數K=________________ (不要求得出計算結果,只需列出數字計算式)。
④C點比B點所產生的NO的物質的量少的主要原因_________________________。
(3)羥胺(NH2OH)的電子式_____________,羥胺是一種還原劑,可用作顯像劑還原溴化銀生成銀單質和氮氣,該反應的化學方程式為________________________________________。現用25.00mL0.049mol/L的羥胺的酸性溶液跟足量的硫酸鐵溶液在煮沸條件下反應,生成的Fe2+恰好與24.50mL 0.020mol/L的KMnO4酸性溶液完全作用,則在上述反應中,羥胺的氧化產物是________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】四種短周期元素A、B、C、D的性質或結構信息如下:
信息:①原子半徑:A<B<C<D。②四種元素之間形成的某三種分子的比例模型及部分性質如下:
物質 | 比例模型圖 | 存在或性質 |
甲 |
| 是地球上最常見的物質之一,是所有生命體生存的重要資源,約占人體體重的三分之二 |
乙 |
| 無色,無氣味并且易燃。是常見的一種基礎能源 |
丙 |
| 有強氧化性的弱酸,有漂白性,可用于消毒殺菌 |
請根據上述信息回答下列問題。
(1)A的元素符號是___;C元素在元素周期表中的位置是___;甲的電子式是___。
(2)丙可由D元素的單質與物質甲反應得到,該反應的離子方程式是___;D所在周期中,E元素的單質還原性最強,則E的單質與甲反應后的溶液呈___(填“酸”或“堿”)性,用電離方程式表示其原因是___。
(3)①A、B、C元素可組成多種化合物。由A、C組成的一種化合物丁,其產量常常用來衡量一個國家石油化工發展水平,則實驗室中可用來除去乙中少量丁的試是___。
②A、C組成的化合物中,化學式為C2A6,該物質與D的單質發生反應的類型___,寫出其中一個化學方程式是___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】科學家利用回旋加速器,用具有20個質子的鈣元素的同位素反復轟擊含95個質子的镅元素,結果4次成功制成4個第115號元素的原子。這4個原子在生成數微秒后衰變成第113號元素。前者的一種核素為![]() 。下列有關敘述正確的是( )
。下列有關敘述正確的是( )
A.鈣元素與镅元素制成第115號元素屬于化合反應
B.113號元素最高正價應為+3
C.核素![]() 中中子數與質子數之差為174
中中子數與質子數之差為174
D.115號與113號元素的相對原子質量之比115:113
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】請將符合題意的下列變化的序號填在對應的橫線上:①碘的升華;②氧氣溶于水;③氯化鈉溶于水;④燒堿熔化;⑤氯化氫溶于水;⑥氯化銨受熱分解。
(1)化學鍵沒有被破壞的是__________;僅發生離子鍵破壞的是__________;
(2)即發生離子鍵破壞、又發生共價鍵破壞的是____________________;
(3)N2的電子式為__________;Na2O2的電子式為___________;CO2的電子式為_________;
(4)用電子式表示MgCl2的形成過程 _____________________;
(5)已知拆開1 mol H—H鍵、1 mol N≡N、1 mol N—H鍵分別需要吸收的能量為436 kJ、946 k J、391 k J。則由N2和H2反應生成1 mol NH3 需要放出_____的熱量。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com