
【題目】實驗室用綠礬(FeSO4·7H2O)為原料制備補血劑甘氨酸亞鐵[(H2NCH2COO)2Fe],有關物質性質如下:
甘氨酸(H2NCH2COOH) | 檸檬酸 | 甘氨酸亞鐵 |
易溶于水,微溶于乙醇,兩性化合物 | 易溶于水和乙醇,有酸性和還原性 | 易溶于水,難溶于乙醇 |
實驗過程:
I.配制含0.10molFeSO4的綠礬溶液。
II.制備FeCO3:向配制好的綠礬溶液中,緩慢加入200mL1.1mol/LNH4HCO3溶液,邊加邊攪拌,反應結束后過濾并洗滌沉淀。
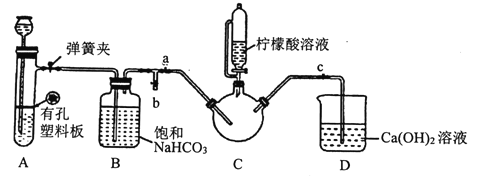
III.制備(H2NCH2COO)2Fe:實驗裝置如下圖(夾持和加熱儀器已省略),將實驗II得到的沉淀和含0.20mol甘氨酸的水溶液混合后加入C中,然后利用A中反應產生的氣體將C中空氣排凈,接著滴入檸檬酸溶液并加熱。反應結束后過濾,濾液經蒸發結晶、過濾、洗滌、干燥得到產品。
回答下列問題:
(1)實驗I中:實驗室配制綠礬溶液時,為防止FeSO4被氧化變質,應加入的試劑為____(寫化學式)。
(2)實驗II中:生成沉淀的離子方程式為________________。
(3)實驗III中:
①檢查裝置A的氣密性的方法是_________。
②裝置A中所盛放的藥品是_______ (填序號)。
a.Na2CO3和稀H2SO4 b.CaCO3和稀H2SO4 c.CaCO3和稀鹽酸
③確認c中空氣排盡的實驗現象是______________。
④加入檸檬酸溶液一方面可調節溶液的pH促進FeCO3溶解,另一個作用是_______。
⑤洗滌實驗III中得到的沉淀,所選用的最佳洗滌試劑是___(填序號)。
a.熱水 b.乙醇溶液 c.檸檬酸溶液
⑥若產品的質量為17.34g,則產率為_____。
【答案】 Fe Fe2++2HCO3-=FeCO3↓+CO2↑+ H2O 關閉彈簧夾,從長頸漏斗注入一定量的水,使漏斗內的水面高于具支試管中的水面,停止加水一段時間后,若長頸漏斗與具支試管中的液面差保持不變,說明裝置不漏氣 c D中澄清石灰水變渾濁 防止二價鐵被氧化 b 85%
【解析】(1). Fe2+易被空氣中的O2氧化成Fe3+,實驗室配制綠礬溶液時,為防止FeSO4被氧化變質,應加入的試劑為Fe,加入鐵粉后,Fe3+可被鐵粉還原為Fe2+,且不引入雜質,故答案為:Fe;
(2). Fe2+和HCO3-發生反應生成FeCO3沉淀、CO2和H2O,離子方程式為:Fe2++2HCO3-=FeCO3↓+CO2↑+ H2O,故答案為:Fe2++2HCO3-=FeCO3↓+CO2↑+ H2O;
(3). ①. 檢查裝置A氣密性的方法是:關閉彈簧夾,從長頸漏斗注入一定量的水,使漏斗內的水面高于具支試管中的水面,停止加水一段時間后,若長頸漏斗與具支試管中液面的高度差保持不變,說明裝置不漏氣,故答案為:關閉彈簧夾,從長頸漏斗注入一定量的水,使漏斗內的水面高于具支試管中的水面,停止加水一段時間后,若長頸漏斗與具支試管中的液面差保持不變,說明裝置不漏氣;
②. 裝置A為固液不加熱型制氣裝置,且具有隨開隨用、隨關隨停的特點,所以應選擇塊狀不溶于水的CaCO3,酸只能選擇鹽酸,若選擇硫酸,生成的CaSO4微溶于水,阻礙反應的進行,故答案選:C;
③. 當C中充滿CO2后,CO2開始進入D中,使D中的澄清石灰水變渾濁,這時說明C中空氣已經排盡,故答案為:D中澄清石灰水變渾濁;
④. 由題中信息可知,檸檬酸具有強還原性,可防止Fe2+被氧化,故答案為:防止二價鐵被氧化;
⑤. 因甘氨酸亞鐵易溶于水,難溶于乙醇,所以應選擇乙醇溶液作為洗滌劑,故答案為:B;
⑥. 含0.10mol FeSO4的綠礬溶液中Fe2+的物質的量為0.10mol,因NH4HCO3溶液過量,所以生成(NH2CH2COO)2Fe的物質的量為0.10mol、質量為20.4g,則產率為:![]() ×100%=85%,故答案為:85%。
×100%=85%,故答案為:85%。


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】用NA表示阿伏加德羅常數的值,下列敘述正確的是( S-32 O-16 ) ( )
A.標準狀況下,22.4L氦氣含有2NA個氦原子
B.在常溫常壓下,11.2L Cl2含有的分子數為0.5NA
C.常溫常壓下,64g SO2中含有的氧原子數為2NA
D.標準狀況下,11.2LH2O含有的分子數為0.5NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知NaH和H2O反應生成H2和NaOH,反應中1mol NaH( )
A.得到1 mol e﹣
B.失去1 mol e﹣
C.失去2 mol e﹣
D.沒有電子得失
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溶液中只含有Ba2+ Mg2+ Ag+三種陽離子,現用適量的NaOH溶液、稀鹽酸和Na2SO4溶液將這三種離子逐一沉淀分離,其流程如圖所示:
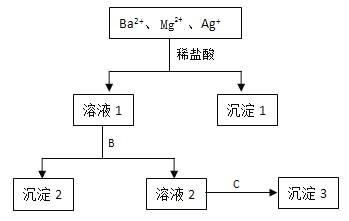
(1)沉淀1的化學式為 ,生成該沉淀的離子方程式為 。
(2)若試劑B為Na2SO4溶液,則沉淀2化學式為 。
(3)若試劑B為NaOH溶液,則生成沉淀2的離子方程式為 。
(4)如果原溶液中Ba2+ Mg2+ Ag+的濃度均為0.1 mol·L-1,且溶液中含有的陰離子只有NO3-,則溶液中NO3- 濃度為 mol·L-1。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定體積的密閉容器中,進行如下反應:CO2(g)+H2(g) ![]() CO(g)+H2O(g),其化學平衡常數K和溫度t的關系如下表所示:
CO(g)+H2O(g),其化學平衡常數K和溫度t的關系如下表所示:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列問題:
(1)該反應化學平衡常數的表達式:K=_______________________________;
(2)該反應為________(填“吸熱”或“放熱”)反應;
(3)下列說法中不能說明該反應達平衡狀態的是__________
A、容器中壓強不變
B、混合氣體中c(CO)不變
C、混合氣體的密度不變
D、V正(H2)=V逆(H2)
E、單位時間內生成CO2的分子數與生成H2O的分子數相等
(4)某溫度下,各物質的平衡濃度符合下式:c(CO2)×c(H2)=c(CO)×c(H2O),試判此時的溫度為__________℃。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】近年來,人類生產、生活所產生的污染使灰霾天氣逐漸增多。灰霾粒子的平均直徑在1000nm~2000nm。下列有關說法正確的是
A. 灰霾可能來自汽車尾氣 B. 灰霾屬于膠體
C. 灰霾形成的是非常穩定的體系 D. 戴口罩不能阻止呼入灰霾粒子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列過程中發生的化學反應屬于加成反應的是( )
A.用光照射甲烷與氯氣的混合氣體
B.將乙烯通入溴的四氯化碳溶液中
C.乙醇和酸性重鉻酸鉀溶液的反應
D.甲烷在空氣中完全燃燒
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com