
| A. | 反應CaO+H2O═Ca(OH)2能放出大量的熱,故可通過原電池實現該反應,并把化學能轉化為電能 | |
| B. | 在原電池或電解池裝置中,都可實現反應:Cu+2H+═Cu2++H2 | |
| C. | 若原電池的兩極是活潑性不同的兩種金屬,則活潑的金屬不一定做負極 | |
| D. | 在鋼鐵制品上鑲嵌鋅塊構成原電池以防治鋼鐵生銹,這種防護方法叫外加電源陰極保護法 |
分析 A.能設計成原電池的反應必須是自發進行的放熱的氧化還原反應;
B.Cu+2H+═Cu2++H2不是自發的氧化還原反應;
C.原電池中失電子的一極為負極;
D.作原電池的正極被保護,屬于犧牲陽極的陰極保護法.
解答 解:A.能設計成原電池的反應必須是自發進行的放熱的氧化還原反應,CaO+H2O═Ca(OH)2不是氧化還原反應,所以不能設計成原電池,故A錯誤;
B.Cu+2H+═Cu2++H2不是自發的氧化還原反應,不能形成原電池,故B錯誤;
C.原電池中失電子的一極為負極,活潑的金屬不一定做負極,如鐵和濃硝酸發生鈍化現象,銅易濃硝酸反應,所以Cu、Fe和濃硝酸形成的原電池中,Cu作負極、Fe作正極,故C正確;
D.在鋼鐵制品上鑲嵌鋅塊構成原電池以防治鋼鐵生銹,Fe作原電池的正極被保護,屬于犧牲陽極的陰極保護法,故D錯誤;
故選C.
點評 本題考查了原電池原理,知道原電池反應特點、正負極的判斷方法即可解答,易錯選項是C,注意:不能根據金屬的活潑性強弱判斷正負極,要根據失電子的難易程度判斷正負極,為易錯點;題目難度不大.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
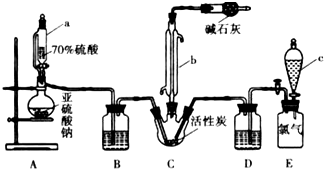 硫酰氯(SO2Cl2)是一種重要的化工試劑,實驗室合成硫酰氯的實驗裝置如圖所示:
硫酰氯(SO2Cl2)是一種重要的化工試劑,實驗室合成硫酰氯的實驗裝置如圖所示:查看答案和解析>>
科目:高中化學 來源: 題型:填空題
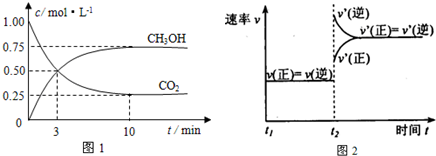
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
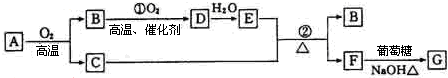
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 一項 | B. | 二項 | C. | 三項 | D. | 四項 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | X | Y |
| A | Al | NaOH溶液 |
| B | NO2 | H2O |
| C | Na2O2 | CO2 |
| D | Cu | 濃HNO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.25 | B. | 0.1 | C. | 0.5 | D. | 0.05 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com