
下列對一些實驗事實的理論解釋正確的是 ( )
選項 | 實驗事實 | 理論解釋 |
A | 氮原子的第一電離能大于氧原子 | 氮原子2p軌道半充滿 |
B | CO2為直線形分子 | CO2分子中C |
C | 金剛石的熔點低于石墨 | 金剛石是分子晶體,石墨是原子晶體 |
D | HF的沸點高于HCl | HF的相對分子質量小于HCl |
 小學能力測試卷系列答案
小學能力測試卷系列答案科目:高中化學 來源:2015-2016學年河北武邑中學高一下第二次月考化學試卷(解析版) 題型:簡答題
I.一定溫度下將6mol的A及6molB混合于2L的密閉容器中,發生如下反應:3A(g)+B(g) xC(g)+2D(g),經過5分鐘后反應達到平衡,測得A的轉化率為60%,C的平均反應速率是0.36mol/(L·min)。求:
xC(g)+2D(g),經過5分鐘后反應達到平衡,測得A的轉化率為60%,C的平均反應速率是0.36mol/(L·min)。求:
(1)平衡時D的濃度= ,
(2)B的平均反應速率v(B)= ,
(3)x= ,
(4)開始時容器中的壓強與平衡時的壓強之比為 (化為最箭整數比)
II.將CH4設計成燃料電池,裝置如圖所示(A、B為多孔碳棒)
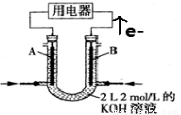
(5) (填A或B)處電極入口通甲烷,其電極反應式為 ;
(6)當消耗甲烷的體積為11.2 L(標準狀況下)時,則消耗KOH的物質的量為 。
(7)以NH3代替氫氣研發燃料電池是當前科研的一個熱點。使用的電解質溶液是2mol·L-1的KOH溶液,電池總反應為:4NH3+3O2=2N2+6H2O。該電池負極的電極反應式為 ;每消耗3.4gNH3轉移的電子數目為 。
查看答案和解析>>
科目:高中化學 來源:2015-2016學年江蘇省高一下第二次月考化學試卷(解析版) 題型:選擇題
下列有關實驗操作、現象或結論的敘述正確的是________________
A.制備硝基苯的實驗中, 水浴加熱可以較好的保持恒溫條件。
B.乙醇的催化氧化實驗中銅絲主要起氧化劑的作用。
C.制取乙酸乙酯時,試劑加入的順序是:先加入乙醇,后慢慢加入濃硫酸,最后加入乙酸。
D.在蔗糖溶液中加入少量稀硫酸,水浴加熱后,再加入銀氨溶液,熱水浴加熱,沒有銀鏡生成,說明蔗糖沒有水解。
E.除去甲烷中混有的少量乙烯,可以將混合氣體通過酸性KMnO4溶液
F.用鈉可以檢驗某無水酒精中是否含有水
查看答案和解析>>
科目:高中化學 來源:2015-2016學年江蘇省高一下第二次月考化學試卷(解析版) 題型:選擇題
化學反應中的能量變化是由化學反應中舊化學鍵斷裂時吸收的能量 與新化學鍵形成時放出的能量不同引起的。如圖為N2(g)和O2(g)反應生成NO(g)過程中的能量變化:
與新化學鍵形成時放出的能量不同引起的。如圖為N2(g)和O2(g)反應生成NO(g)過程中的能量變化:
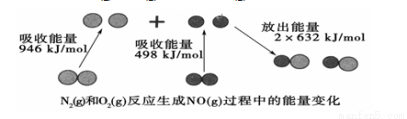
下列說法中正確的是( )
A.1 mol N2(g)和1 mol O2(g)反應放出的能量為180 kJ
B.通常情況下,N2(g)和O2(g)混合能直接生成NO
C.1 mol N2(g)和1 mol O2(g)具有的總能量小于2 mol NO(g)具有的總能量
D.NO是一種酸性氧化物,能與NaOH溶液反應生成鹽和水
查看答案和解析>>
科目:高中化學 來源:2015-2016學年江蘇省高二下第二次月考化學試卷(解析版) 題型:填空題
某汽車安全氣囊的產氣藥劑主要含有NaN3、Fe2O3、KClO4、NaHCO3等物質。當汽車發生碰撞時,產氣藥劑產生大量氣體使氣囊迅速膨脹,從而起到保護作用。
(1)NaN3是氣體發生劑,受熱分解產生N2和Na,N2的電子式為________。
(2)Fe2O3是主氧化劑,與Na發生置換反應生成的還原產物為________。
(3)KClO4是助氧化劑,反應過程中與Na作用生成KCl和Na2O。KClO4含有化學鍵的類型為________,金屬晶體K的堆積方式為________。
(4)NaHCO3是冷卻劑,吸收產氣過程中釋放的熱量而發生分解,其化學方程式為______
__________________________________。
(5)100 g上述產氣藥劑產生的氣體通過堿石灰后得到N2 33.6 L(標準狀況)。
①用堿石灰除去的物質為________________;
②該產氣藥劑中NaN3的質量分數為________。
查看答案和解析>>
科目:高中化學 來源:2015-2016學年江蘇省高二下第二次月考化學試卷(解析版) 題型:選擇題
根據原子結構及元素周期律的知識,下列敘述正確的是( )
A.由于分子中氫原子數:H2SO4>HClO4 ,故酸性:H2SO4>HClO4
B.硅處于金屬與非金屬的過渡位置,硅可用作半導體材料
C.由于氮元素的最低化合價只有-3價,故NH5這種物質不可能存在
D.Cl-、S2-、Ca2+、K+半徑逐漸減小
查看答案和解析>>
科目:高中化學 來源:2015-2016學年湖北省高二5月月考化學試卷(解析版) 題型:簡答題
(1)在其他條件不變的情況下,起始氫氣的物質的量[用n(H2)表示]對N2(g)+3H2(g) 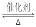 2NH3(g)反應的影響可表示成如圖所示的規律(圖中
2NH3(g)反應的影響可表示成如圖所示的規律(圖中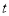 表示溫度,
表示溫度, 表示物質的量)。
表示物質的量)。

①比較在a、b、c三點處的平衡狀態中,反應物N2的轉化率最高的是__________。
②若容器容積為1L,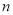 =3mol,反應達到平衡時H2的轉化率為60%,則在起始時體系中加入N2的物質的量為__________mol,此條件下(t2)反應的平衡常數
=3mol,反應達到平衡時H2的轉化率為60%,則在起始時體系中加入N2的物質的量為__________mol,此條件下(t2)反應的平衡常數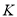 =________。
=________。
③圖像中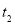 和
和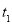 的關系是t2 ______ t1(填“高于”“低于”“等于”或“無法確定”)。
的關系是t2 ______ t1(填“高于”“低于”“等于”或“無法確定”)。
(2)氨氣和氧氣與145 時開始反應,在不同溫度和催化劑條件下生成不同產物(如圖所示)
時開始反應,在不同溫度和催化劑條件下生成不同產物(如圖所示)

4NH3+5O2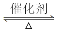 4NO+6H2O
4NO+6H2O
4NH3+3O2 2N2+6H2O
2N2+6H2O
溫度較低時以生成________為主,溫度高于900 時,NO產率下降的原因是______。
時,NO產率下降的原因是______。
查看答案和解析>>
科目:高中化學 來源:2015-2016學年遼寧東北育才學校高一下第二段考化學試卷(解析版) 題型:實驗題
某化學實驗小組擬用以下裝置由乙醇與濃硫酸共熱制備乙烯,且進行乙烯的催化氧化實驗.
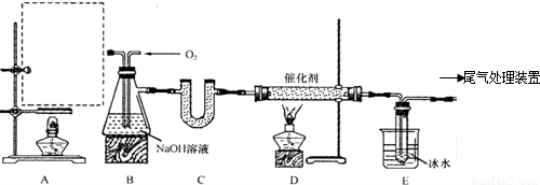
(1)在A處虛線框內繪出該實驗裝置圖.
(2)制取乙烯的化學方程式為 .
(3)裝置B中盛有NaOH溶液,除了便于觀察乙烯和氧氣的流速以外,還具有的作用是:
① ;② .
(4)若E中收集到的物質為CH3CHO,則D中發生反應的化學方程式為 .
(5)用乙醇、濃硫酸共熱制乙烯,所得乙烯產率較低,原因可能是 .
A.乙醇部分揮發
B.乙醇部分生成乙醚
C.乙醇被氧化為C、CO、CO2
D.加熱速度過快.
查看答案和解析>>
科目:高中化學 來源:2015-2016學年遼寧東北育才學校高二下第二段考化學試卷(解析版) 題型:選擇題
有機物分子中原子間(或原子與原子團間)的相互影響會導致物質化學性質的不同。下列事實不能說明上述觀點的是( )
A.苯酚能跟NaOH溶液反應,乙醇不能與NaOH溶液反應
B.乙烯能發生加成反應,乙烷不能發生加成反應
C.甲苯能使酸性高錳酸鉀溶液褪色,苯不能使酸性高錳酸鉀溶液褪色
D.苯與硝酸在加熱時發生取代反應,甲苯與硝酸在常溫下就能發生取代反應
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com