
分析 根據Qc≥Ksp分析求解,KI可與Pb(NO3)2反應生成PbI2,將等體積的KI溶液與Pb(NO3)2溶液混合,若KI的濃度為1×10-2mo1/L,則混合后c(I-)═5×10-3mol/L,根據Ksp=c[Pb(NO3)2]•c2(I-)計算即可.
解答 解:根據題意,KI可與Pb(NO3)2反應,沉淀是PbI2,若原KI溶液的濃度為1×10-2mo1/L,等體積混合后,c(I-)═5×10-3mol/L,根據Ksp=c[Pb(NO3)2]•c2(I-),則生成沉淀時,混合溶液中的Pb(NO3)2溶液的最小濃度c[Pb(NO3)2]=$\frac{{K}_{sp}}{{c}^{2}({I}^{-})}$=$\frac{7.0×1{0}^{-9}}{(5×1{0}^{-3})^{2}}$=2.8×10-4(mol/L),混合前,即原Pb(NO3)2溶液的最小濃度為2×2.8×10-4mol/L=5.6×10-4mol/L.
故答案為:5.6×10-4mol/L.
點評 本題考查溶度積的計算,根據Qc≥Ksp分析求解是解答關鍵,題目難度不大.


科目:高中化學 來源: 題型:解答題
| 時間(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
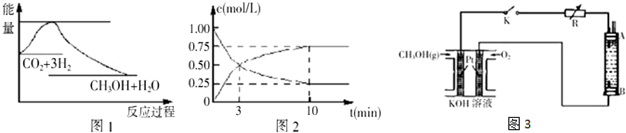
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
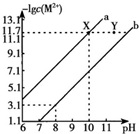 25℃時,Fe(OH)2和Cu(OH)2的飽和溶液中,金屬陽離子的物質的量濃度的負對數[-lgC(M2+)]與溶液PH的變化關系如圖所示,已知:該溫度下,Ksp[Cu(OH)2]<Ksp[Fe(OH)2].下列說法正確的是( )
25℃時,Fe(OH)2和Cu(OH)2的飽和溶液中,金屬陽離子的物質的量濃度的負對數[-lgC(M2+)]與溶液PH的變化關系如圖所示,已知:該溫度下,Ksp[Cu(OH)2]<Ksp[Fe(OH)2].下列說法正確的是( )| A. | b線表示Fe(OH)2飽和溶液中的變化關系,且Ksp[Fe(OH)2]=10-15.1 | |
| B. | 當Fe(OH)2和Cu(OH)2沉淀共存時,溶液中C(Fe2+):C(Cu2+)=1:104.6 | |
| C. | 向X點對應的飽和溶液中加入少量NaOH,可轉化為Y點對應的溶液 | |
| D. | 除去CuSO4溶液中含有的少量Fe2+,可加入適量CuO |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
| 實驗組 | 溫度/℃ | 起始量/mol | 平衡量/mol | 達到平衡所需時間/min | ||
| H2O | CO | CO2 | CO | |||
| A | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| B | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| C | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 物質 | X | Y | Z |
| 初始濃度/(mol•L-1) | 0.1 | 0.2 | 0 |
| 2min末濃度/(mol•L-1) | 0.08 | a | b |
| 平衡濃度/(mol•L-1) | 0.05 | 0.05 | 0.1 |
| A. | 平衡時,X的轉化率為20% | |
| B. | 2min時Y的物質的量為0.14 | |
| C. | 增大平衡后的體系壓強,v(正)增大,v(逆)減小 | |
| D. | 2min內,用Y的變化量表示的平均反應速率v(Y)=0.03mol•L-1•min-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | H2O(g)═H2(g)+O2(g)△H=+242 kJ•mol-1 | B. | 2H2(g)+O2(g)═2H2O(l)△H=-484 kJ•mol-1 | ||
| C. | H2(g)+O2(g)═H2O(g)△H=+242 kJ•mol-1 | D. | 2H2(g)+O2(g)═2H2O(g)△H=+484 kJ•mol-1 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com