
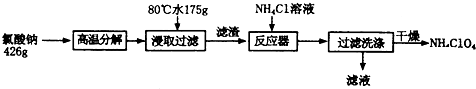
分析 據氧化還原反應原理和信息,氯酸鈉受熱分解生成高氯酸鈉和氯化鈉,可由圖知,NaClO4的溶解度受溫度影響很大,NaCl溶解度受溫度影響不大,80℃時浸取液冷卻至0℃過濾,高氯酸鈉的溶解度迅速降低,析出晶體,高氯酸鈉中加入氯化銨飽和溶液,反應向著更難溶的物質轉化,根據物質的溶解情況,可以知道會析出高氯酸銨,過濾洗滌干燥就可以得到高氯酸銨的固體.
(1)根據題干信息:氯酸鈉受熱分解生成高氯酸鈉和氯化鈉來書寫方程式;
(2)根據溫度和物質的溶解度的關系知道:高氯酸鈉的溶解度受溫度影響大,但是氯化鈉的溶解度受溫度影響不大;
(3)向高氯酸鈉中加入氯化銨,沉淀向著更難溶的物質轉化;
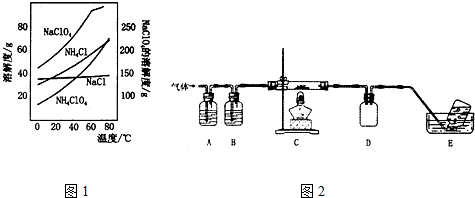
(4)氯氣能被NaOH吸收,水可以被濃硫酸吸收,氧氣可以被熱的Cu吸收,氮氣可以用排水法收集,氫氧化鈉中有水,先是吸收氯氣,再是將水吸收,最后吸水的是氧氣,所以A、B、C中盛放的藥品依次可以是c.NaOH b.濃H2SO4 e.Cu,最后用排水法收集氮氣,據此分析;
(5)過濾用到的主要玻璃儀器是玻璃棒、燒杯和漏斗.
解答 解:(1)根據氧化還原反應原理和信息,氯酸鈉受熱分解生成高氯酸鈉和氯化鈉,得到方程式為4NaClO3$\frac{\underline{\;\;△\;\;}}{\;}$3NaClO4+NaCl,
故答案為:4NaClO3$\frac{\underline{\;\;△\;\;}}{\;}$3NaClO4+NaCl;
(2)可由圖知,NaClO4的溶解度受溫度影響很大,NaCl溶解度受溫度影響不大,80℃時浸取液冷卻至0℃過濾,高氯酸鈉的溶解度迅速降低,析出晶體,但是氯化鈉的溶解度受溫度的影響不大,不會析出晶體,故答案為:NaClO4;
(3)反應器高氯酸鈉中加入氯化銨飽和溶液,反應向著更難溶的物質轉化,根據物質的溶解情況,可以知道會析出高氯酸銨,即發生反應的離子方
程式為NH4++ClO4-=NH4ClO4,故答案為:NH4++ClO4-=NH4ClO4;
(4)氯氣能被NaOH吸收,水可以被濃硫酸吸收,氧氣可以被熱的Cu吸收,氮氣可以用排水法收集,氫氧化鈉中有水,先是吸收氯氣,再是將水吸收,最后吸水的是氧氣,所以A、B、C中盛放的藥品依次可以是c.NaOH b.濃H2SO4 e.Cu,最后用排水法收集氮氣,
①E中收集到的氣體只能是氮氣,故答案為:N2;
②A、B、C中盛放的藥品依次可以是c.NaOH b.濃H2SO4 e.Cu,故答案為:Ⅱ;
(5)過濾用到的主要玻璃儀器是玻璃棒、燒杯和漏斗,故答案為:玻璃棒、燒杯和漏斗.
點評 本題是一道物質的分離和提純的實驗方案設計題,考查學生分析和解決問題的能力,難度大.


科目:高中化學 來源:2016-2017學年云南省高一9月月考化學卷(解析版) 題型:簡答題
(1)火藥是中國的“四大發明”之一,永遠值得炎黃子孫驕傲,也永遠會激勵著我們去奮發圖強。黑火藥在發生爆炸時,發生如下的反應:2KNO3+C+S===K2S+2NO2↑+CO2↑。被氧化的元素是 ,氧化劑是 ,還原產物是 。電子轉移的總數為__________。
(2)國家衛生部在2000年前就決定逐步使用穩定、高效、無毒的二氧化氯取代氯氣消毒飲用水。已知二氧化氯溶于水時有亞氯酸根離子(ClO2-)生成,且氧化產物與還原產物的物質的量之比為1∶1。二氧化氯溶于水的反應方程式2ClO2 + H2O=HClO3 + HClO2,請用單線橋標明電子轉移方向和數目并指出氧化產物。2ClO2 + H2O=HClO3 + HClO2
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
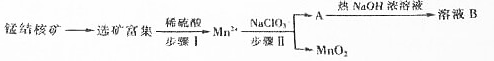
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-39 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
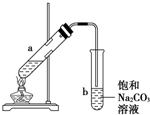 如圖為實驗室制取少量乙酸乙酯的裝置圖,下列關于該實驗的敘述中,不正確的是( )
如圖為實驗室制取少量乙酸乙酯的裝置圖,下列關于該實驗的敘述中,不正確的是( )| A. | 向a試管中先加入乙醇,然后邊搖動試管邊慢慢加入濃硫酸,再加冰醋酸 | |
| B. | 試管b中導氣管下端管口不能浸入液面的原因是防止實驗過程中發生倒吸現象 | |
| C. | 實驗時加熱試管a的目的是及時將乙酸乙酯蒸出并加快反應速率 | |
| D. | 可將飽和碳酸鈉溶液換成氫氧化鈉溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
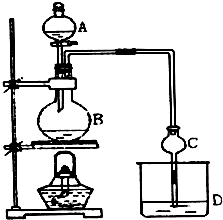 某課外小組設計的實驗室制取乙酸乙酯的裝置如圖所示,A中放有濃硫酸,B中放有乙醇、無水醋酸鈉,D中放有飽和碳酸鈉溶液.
某課外小組設計的實驗室制取乙酸乙酯的裝置如圖所示,A中放有濃硫酸,B中放有乙醇、無水醋酸鈉,D中放有飽和碳酸鈉溶液.| 試劑 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸點(℃) | 34.7 | 78.5 | 118 | 77.1 |
 CH3CO18OC2H5+H2O.
CH3CO18OC2H5+H2O.查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 明礬凈水時使水中懸浮顆粒沉淀 | |
| B. | 清晨樹林中的道道光柱 | |
| C. | 霧霾天氣打手電能看到明顯的光柱 | |
| D. | 澄清石灰水中通入CO2氣體,有白色的沉淀 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com