
【題目】向密閉容器中充入CO和![]() 各
各![]() mol,一定溫度下發生反應:
mol,一定溫度下發生反應:![]() ,下列敘述正確的是
,下列敘述正確的是
A.如果容器內壓強不再改變,則證明該反應已達到平衡狀態
B.尋找合適的催化劑是加快反應速率并提高![]() 產率的有效措施
產率的有效措施
C.當反應達到平衡后,保持容器內體積不變,再向其中充入CO和![]() 各1mol,達到新的平衡后
各1mol,達到新的平衡后![]() 的產率會增大
的產率會增大
D.如果在某溫度下平衡常數為![]() ,則平衡時CO轉化率為
,則平衡時CO轉化率為![]()
【答案】D
【解析】
![]() 對于反應前后氣體分子數不變的反應,容器內的總壓強不隨時間的變化而改變,如果容器內壓強不再改變,不能說明反應達到平衡狀態,故A錯誤;
對于反應前后氣體分子數不變的反應,容器內的總壓強不隨時間的變化而改變,如果容器內壓強不再改變,不能說明反應達到平衡狀態,故A錯誤;
B.尋找合適的催化劑是加快反應速率的有效措施,但催化劑不能改變平衡,所以不能提高![]() 產率,故B錯誤;
產率,故B錯誤;
C. 當反應達到平衡后,保持容器內體積不變,再向其中充入CO和![]() 各1mol,這是與原投料成比例地再投入反應物,雖然體系的壓強會增大,但該反應是前后氣體分子數不變的反應,達到平衡后與原平衡等效,
各1mol,這是與原投料成比例地再投入反應物,雖然體系的壓強會增大,但該反應是前后氣體分子數不變的反應,達到平衡后與原平衡等效, ![]() 的產率不變,故C錯誤;
的產率不變,故C錯誤;
D.設容器體積是1L,設CO的變化量為x mol/L,由![]() 可知,各組分的變化量均為x mol/L, 則
可知,各組分的變化量均為x mol/L, 則![]() 的平衡量分別為(0.01 -x)mol/L、(0.01 -x)mol/L、x mol/L、x mol/L,因此,
的平衡量分別為(0.01 -x)mol/L、(0.01 -x)mol/L、x mol/L、x mol/L,因此, ![]() ,解之得,
,解之得,![]() ,CO的平衡轉化率
,CO的平衡轉化率![]() ,故D正確;
,故D正確;
故選:D。


科目:高中化學 來源: 題型:
【題目】設NA表示阿伏加德羅常數的值。下列敘述正確的是
A.4.0 g由CO2和SO2組成的混合物中含有的質子數為2NA
B.2.24 L Cl2與CH4在光照下反應生成的HCl分子數為0.1NA
C.0.1 mol/L K2S溶液中含有的K+數為0.2NA
D.4.2 g CaH2與水完全反應,轉移的電子數為0.1NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用下圖裝置進行實驗,開始時,a、b兩處液面相平,密封好,放置一段時間。下列說法不正確的是( )

A. a管發生吸氧腐蝕,b管發生析氫腐蝕
B. 一段時間后,a管液面高于b管液面
C. a處溶液的pH增大,b處溶液的pH減小
D. a、b兩處具有相同的電極反應式:Fe-2e-===Fe2+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國對“可呼吸”的鈉——二氧化碳電池的研究取得突破性進展。該電池的總反應式為4Na+3CO2![]() 2Na2CO3+C,其工作原理如圖所示(放電時產生的Na2CO3固體貯存于碳納米管中)。
2Na2CO3+C,其工作原理如圖所示(放電時產生的Na2CO3固體貯存于碳納米管中)。
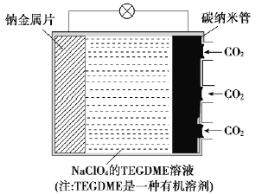
(1)鈉金屬片作為該電池的___極(填“正”或“負”,下同);放電時,電解質溶液中Na+從___極區向___極區移動。
(2)充電時,碳納米管連接直流電源的___極,電極反應式為___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上可用軟錳礦(主要成分是MnO2)和黃鐵礦(主要成分是FeS2)為主要原料制備高性能磁性材料碳酸錳(MnCO3)。其工業流程如下:

回答下列問題:
(1)為了提高溶浸工序中原料的浸出率,可以采取的措施有__________________(寫一條)。
(2)除鐵工序中,在加入石灰調節溶液的pH前,加入適量的軟錳礦,其作用是______________。
(3)凈化工序的目的是除去溶液中的Cu2+、Ca2+等雜質。若測得濾液中c(F-)=0.01 molL-1,濾液中殘留的c(Ca2+)=________________〔已知:Ksp(CaF2)=1.46×10-10〕,
(4)沉錳工序中,298K、c(Mn2+)為1.05 molL-1時,實驗測得MnCO3的產率與溶液pH、反應時間的關系如圖所示。根據圖中信息得出的結論是______________。
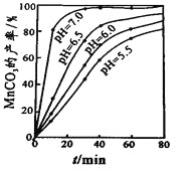
(5)沉錳工序中有CO2生成,則生成MnCO3的離子方程式是______________________。
(6)從沉錳工序中得到純凈MnCO3的操作方法是___________________。副產品A的化學式是________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在兩個固定容積均為1L密閉容器中以不同的氫碳比![]() 充入
充入![]() 和
和![]() ,在一定條件下發生反應:
,在一定條件下發生反應:![]()
![]() 的平衡轉化率
的平衡轉化率![]() 與溫度的關系如圖所示.下列說法正確的是
與溫度的關系如圖所示.下列說法正確的是![]()
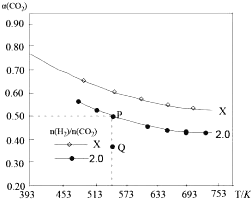
A.該反應在高溫下自發進行
B.X的氫碳比![]() ,且Q點在氫碳比為
,且Q點在氫碳比為![]() 時
時![]()
C.若起始時,![]() 、
、![]() 濃度分別為
濃度分別為![]() 和
和![]() ,則可得到P點,對應溫度的平衡常數的值為512
,則可得到P點,對應溫度的平衡常數的值為512
D.向處于P點狀態的容器中,按2:4:1:4的比例再充入![]() 、
、![]() 、
、![]() 、
、![]() ,再次平衡后
,再次平衡后![]() 減小
減小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在容積為![]() L的密閉容器內,物質D在
L的密閉容器內,物質D在![]() 時發生反應,其反應物和生成物的物質的量隨時間t的變化關系如圖,下列敘述錯誤的是
時發生反應,其反應物和生成物的物質的量隨時間t的變化關系如圖,下列敘述錯誤的是
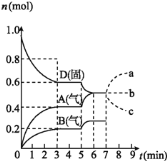
A.從反應開始到第一次達到平衡時,B物質的平均反應速率為![]()
![]()
B.根據如圖該反應的平衡常數表達式為![]()
C.若在第5min時升高溫度,則該反應的正反應是吸熱反應,反應的平衡常數增大,B的反應速率增大
D.若在第7分鐘時增加D的物質的量,A的物質的量變化情況符合a曲線
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NH3和O2在一定條件下發生反應:4NH3(g)+3O2(g) ![]() 2N2(g)+6H2O(g),現向一容積不變的2 L密閉容器中充入4 mol NH3和3 mol O2,4 min后反應達到平衡,測得生成的H2O(g)占混合氣體總體積的40%,則下列表示的此段時間內該反應的平均速率不正確的是( )
2N2(g)+6H2O(g),現向一容積不變的2 L密閉容器中充入4 mol NH3和3 mol O2,4 min后反應達到平衡,測得生成的H2O(g)占混合氣體總體積的40%,則下列表示的此段時間內該反應的平均速率不正確的是( )
A. v(N2)=0.125 mol·L-1·min-1B. v(H2O)=0.375 mol·L-1·min-1
C. v(O2)=0.225 mol·L-1·min-1D. v(NH3)=0.25 mol·L-1·min-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用酸性氫氧燃料電池為電源進行電解的實驗裝置示意圖如下圖所示。下列說法中,正確的是
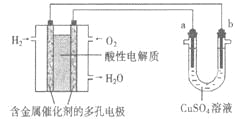
A.若a極是銅,b極為鐵時,當電池消耗1.6gO2,b極上析出6.4g銅
B.燃料電池工作時,正極反應為:O2 + 2H2O + 4e-= 4OH-
C.若a極是粗銅,b極是純銅時,a極減少的質量等于b極上析出銅的質量。
D.若a、b兩極均是石墨時,b極反應為4OH-- 4e-=O2↑+ 2H2O
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com