
【題目】FeCl3(aq)與KSCN(aq)混合時存在下列平衡: Fe3+(aq)+SCN-(aq) Fe(SCN)2+(aq)。已知平衡時,c[Fe(SCN)2+]與溫度T的關系如圖所示,則下列說法正確的是
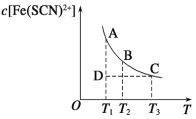
A.FeCl3(aq)與KSCN(aq)的反應是放熱反應
B.T1、T2時反應的平衡常數分別為K1、K2,則K1<K2
C.反應處于D點時,一定有υ正<υ逆
D.恒溫下加入KCl固體,平衡逆向移動
 優百分課時互動系列答案
優百分課時互動系列答案科目:高中化學 來源: 題型:
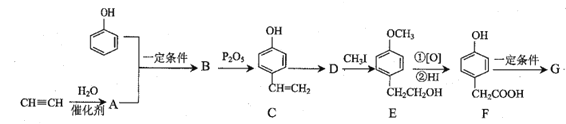
【題目】高分子化合物G的一種合成路線如下:
已知:①![]() +RCHO
+RCHO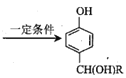 ;
;
②D溶液顯酸性
③濃硫酸能與酚類物質發生取代反應,在苯環上引入-SO2H
回答下列問題:
(1)E分子中的含氧官能團名稱為__。
(2)下列關于化合物B的說法不正確的是__(填標號)。
①苯環上一氯代物有2種
②分子式為C8H10O2
③既能與FeCl3溶液發生顯色反應又能與溴水發生加成反應
④1mol化合物B與足量金屬鈉反應生成標準狀況下氫氣22.4L
(3)A→B的反應類型是__,D→E的目的是__,A的化學名稱為__。
(4)寫出F→G的化學方程式__。
(5)某烴的含氧衍生物X符合下列條件的同分異構體有種__(不含立體異構)。
①氧原子數與B相同但相對分子質量比B少36
②能發生水解反應
其中核磁共振氫譜只有2組峰的是__(寫結構簡式)
(6)寫出用苯酚、![]() 為原料(其他無機試劑任選)制備化合物
為原料(其他無機試劑任選)制備化合物![]() 的合成路線。__。
的合成路線。__。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮及其化合物如NH3及銨鹽、N2H4、N2O4等在中學化學、化工工業、國防等領域占有重要地位。
(1)發射航天火箭常用肼(N2H4)與N2O4作燃料與助燃劑。肼(N2H4)與N2O4的反應為
2N2H4 (g)+ N2O4(g)==3N2(g)+4H2O(g) △H=-1077 kJ·mol-1。
已知相關反應的化學鍵鍵能數據如下表所示:
化學鍵 | N-H | N-N |
| O-H |
E/(kJ·mol-1) | 390 | 190 | 946 | 460 |
①使1 mol N2O4(g)分子中化學鍵完全斷裂時需要吸收的能量是________________。
②下列能說明2N2H4 (g)+ N2O4(g)==3N2(g)+4H2O(g) △H 達平衡狀態的是________
a.混合氣體的平均相對分子質量不變 b.V(N2)=3V( N2O4)
c.N2H4的質量保持不變 d. △H不再變化
(2)N2O4與NO2之間存在反應N2O4(g) ![]() 2NO2(g)。將一定量的N2O4放人恒容密閉容器中,測得其平衡轉化率[α(N2O4)]隨溫度的變化如下圖所示。
2NO2(g)。將一定量的N2O4放人恒容密閉容器中,測得其平衡轉化率[α(N2O4)]隨溫度的變化如下圖所示。

①由圖推測該反應的△H_______0(填>”或“<”),理由為____________________________。
②圖中a點對應溫度下,已知N2O4的起始壓強p0為108 kPa,則該溫度下反應的平衡常數Kp=________________ (用平衡分壓代替平衡濃度計算,分壓=總壓×物質的量分數)。
(3)電解NO2制備NH4NO3,其工作原理如下圖所示。

①陰極的電極反應式為____________________________________________________。
②為使電解產物全部轉化為NH4NO3,需補充某種化合物——物質A,則A的化學式為________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】乙酸乙酯是一種用途廣泛的精細化工產品。工業生產乙酸乙酯的方法很多,如圖:

下列說法正確的是
A. 反應①、②均是取代反應
B. 反應③、④的原子利用率均為100%
C. 與乙酸乙酯互為同分異構體的酯類化合物有2種
D. 乙醇、乙酸、乙酸乙酯三種無色液體可用Na2CO3溶液鑒別
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】處理超標電鍍廢水,使其NaCN含量低于0.5 mg/L,即可達到排放標準,反應分兩步進行。第一步NaCN與NaClO反應,生成NaOCN和NaCl。第二步NaOCN與NaClO反應,生成Na2CO3、CO2、NaCl和N2。已知HCN是弱酸,易揮發,有劇毒;HCN、HOCN中N元素的化合價相同。下列說法正確的是
A. 處理NaCN超標電鍍廢水的過程中無元素化合價的改變
B. 第一步反應溶液應調節為酸性,可避免生成有毒物質HCN
C. 第二步發生的反應為2OCN- + 3ClO- ![]() 2CO2↑ + CO32 + 3Cl- + N2↑
2CO2↑ + CO32 + 3Cl- + N2↑
D. 處理100 m3含NaCN 10.3 mg/L的廢水實際至少需要50 mol NaClO
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,將一定量的氨基甲酸銨置于密閉真空容器中(固體體積忽略不計)發生反應:H2NCOONH4(s)![]() 2NH3(g)+CO2(g)△H,達到平衡時測得c(CO2)=amol·L-1。溫度不變,達到平衡后壓縮容器體積至原來的一半,達到新平衡時測得c(NH3)=xmol·L-1。下列說法正確的是( )
2NH3(g)+CO2(g)△H,達到平衡時測得c(CO2)=amol·L-1。溫度不變,達到平衡后壓縮容器體積至原來的一半,達到新平衡時測得c(NH3)=xmol·L-1。下列說法正確的是( )
A. 混合氣體的平均相對分子質量不再變化時表明達到平衡狀態
B. 達到新平衡時,△H為原來的2倍
C. 上述反應達到新平衡狀態時x=2a
D. 上述反應體系中,壓縮容器體積過程中n(H2NCOONH4)不變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氯化鐵和摩爾鹽是鐵的兩種重要鹽類,在凈水和定量分析等方面具有重要作用。
(1)用FeCl3溶液腐蝕印刷電路板上的銅,向所得溶液中加入鐵粉,對加入鐵粉充分反應后的溶液分析合理的是__________。
a.若無固體剩余,則溶液中一定有Fe3+ b.若有固體存在,則溶液中一定有Fe2+
c.若溶液中有Cu2+,則一定沒有固體析出 d.若溶液中有Fe2+,則一定有Cu析出
(2)工業上通過氧化酸性FeCl2廢液得到含FeCl3的溶液。若酸性FeCl2廢液中c(Fe2+)=2.0×10-2mol·L-1,c(Fe3+)=1.0×10-3mol·L-1, c(Cl-)=5.3×10-2mol·L-1,則該溶液的pH約為____(不考慮水的電離和離子的水解)。
(3)摩爾鹽[(NH4)2Fe(SO4)2·6H2O]在定量分析中常作為基準物質,用來標定重鉻酸鉀、高錳酸鉀等溶液的濃度,在0.1mol·L-1 的該鹽的溶液中,離子濃度由大到小的順序是____
(4)配平離子方程式:___Fe2+ +___ MnO4- +____ H+ → ___Mn2+ +____Fe3+ +___ H2O
(5)已知摩爾鹽相對分子質量為M=392,取摩爾鹽產品23.520g(雜質不與高錳酸鉀反應),配成250mL溶液,取出25mL用0.0500mol·L-1 KMnO4溶液滴定,消耗KMnO4溶液19.50mL,則產品中莫爾鹽的質量分數為__________(用小數表示,保留四位小數)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設![]() 為阿伏伽德羅常數的值,下列說法正確的是
為阿伏伽德羅常數的值,下列說法正確的是![]()
A.![]() 乙醇含有的
乙醇含有的![]() 鍵數為
鍵數為![]()
B.![]() 含有的質子數和中子數均為
含有的質子數和中子數均為![]()
C.每生成![]() ,轉移的電子數一定為
,轉移的電子數一定為![]()
D.標準狀況下,![]() 與
與![]() 充分反應,產物分子數為
充分反應,產物分子數為![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對羥基扁桃酸是農藥、藥物、香料合成的重要中間體,它可由苯酚和乙醛酸在一定條件下反應制得:

下列說法不正確的是
A. 上述反應的原子利用率可達到100%
B. 在核磁共振氫譜中對羥基扁桃酸應該有6個吸收峰
C. 1mol對羥基扁桃酸與足量NaOH溶液反應,消耗3 mol NaOH
D. 可以用FeCl3溶液鑒別乙醛酸和苯酚
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com