
【題目】某小組研究Na2S溶液與KMnO4溶液反應,探究過程如下。
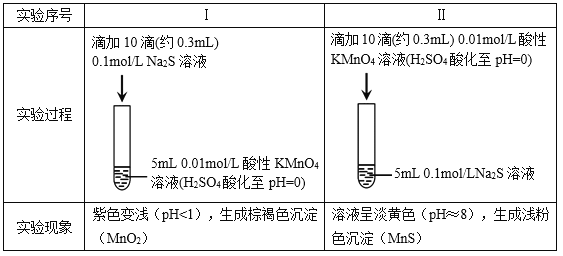
資料:ⅰ. ![]() 在強酸性條件下被還原為Mn2+,在近中性條件下被還原為MnO2。
在強酸性條件下被還原為Mn2+,在近中性條件下被還原為MnO2。
ⅱ. 單質硫可溶于硫化鈉溶液,溶液呈淡黃色。
(1)根據實驗可知,Na2S具有________性。
(2)甲同學預測實驗I中S2–被氧化成![]() 。
。
①根據實驗現象,乙同學認為甲的預測不合理,理由是________。
②乙同學取實驗I中少量溶液進行實驗,檢測到有![]() ,得出S2–被氧化成
,得出S2–被氧化成![]() 的結論,丙同學否定了該結論,理由是________。
的結論,丙同學否定了該結論,理由是________。
③同學們經討論后,設計了如下實驗,證實該條件下![]() 的確可以將S2–氧化成
的確可以將S2–氧化成![]() 。
。
a.右側燒杯中的溶液是________。
b.連通后電流計指針偏轉,一段時間后,________(填操作和現象)。
(3)實驗I的現象與資料i存在差異,其原因是新生成的產物(Mn2+)與過量的反應物(![]() )發生反應,該反應的離子方程式是________。
)發生反應,該反應的離子方程式是________。
(4)實驗II的現象與資料也不完全相符,丁同學猜想其原因與(3)相似,經驗證猜想成立,他的實驗方案是______。
(5)反思該實驗,反應物相同,而現象不同,體現了物質變化不僅與其自身的性質有關,還與________因素有關。
【答案】 還原 溶液呈紫色,說明酸性KMnO4溶液過量, ![]() 能被其繼續氧化 因KMnO4溶液是用H2SO4酸化的,故溶液中出
能被其繼續氧化 因KMnO4溶液是用H2SO4酸化的,故溶液中出![]() 不一定是氧化新生成的 0.01mol/L KMnO4溶液(H2SO4酸化至pH=0) 取左側燒杯中的溶液,用鹽酸酸化后,滴加BaCl2溶液,觀察到有白色沉淀生成 2Mn
不一定是氧化新生成的 0.01mol/L KMnO4溶液(H2SO4酸化至pH=0) 取左側燒杯中的溶液,用鹽酸酸化后,滴加BaCl2溶液,觀察到有白色沉淀生成 2Mn![]() +3Mn2+-+ 2H2O = 5MnO2↓+ 4H+ 將實驗I中生成的MnO2分離洗滌后,加入0.1mol/L Na2S溶液,觀察到有淺粉色沉淀,且溶液呈黃色,證明新生成的MnO2與過量的S2-反應,故沒得到MnO2沉淀 濃度、用量、溶液中的酸堿性
+3Mn2+-+ 2H2O = 5MnO2↓+ 4H+ 將實驗I中生成的MnO2分離洗滌后,加入0.1mol/L Na2S溶液,觀察到有淺粉色沉淀,且溶液呈黃色,證明新生成的MnO2與過量的S2-反應,故沒得到MnO2沉淀 濃度、用量、溶液中的酸堿性
【解析】(1)實驗I中KMnO4反應生成MnO2,Mn元素由+7降到+4價,KMnO4被還原,體現了Na2S的還原性。實驗II中KMnO4反應生成MnS,Mn元素由+7降到+2價,KMnO4被還原,體現Na2S的還原性。故答案為:還原性。
(2)①反應I,溶液紫色變淺,但紫色并未褪去,說明酸性KMnO4過量,KMnO4能與SO32-反應,則甲的預測不合理。故答案為:溶液呈紫色,說明酸性KMnO4溶液過量,SO32-能被其繼續氧化。
②檢驗到溶液中存在SO42-,也不能說明S2-被氧化為SO42-,因KMnO4溶液是用H2SO4酸化的,溶液中本身就存在SO42-。
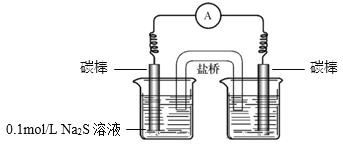
③要證明實驗I中MnO4-的確將S2-氧化為SO42-,則要先排除酸性高錳酸鉀溶液中SO42-的干擾。可以將MnO4-與S2-的氧化還原反應設計成帶鹽橋的原電池,將Na2S和酸性高錳酸鉀分開反應。如圖,如果能在左側燒杯中檢驗到SO42-,說明S2-被氧化為SO42-。
a、由圖可知,右側燒杯中應放0.01mol/L KMnO4溶液(H2SO4酸化至pH=0);
b、根據上述分析,取左側燒杯中的溶液,用鹽酸酸化后,滴加BaCl2溶液,觀察到有白色沉淀生成。
(3)根據資料i可知,在強酸性條件下MnO4-被還原為Mn2+,實驗I結束后溶液依然呈強酸性,但事實上了生成了MnO2。原因是高錳酸鉀過量與生成的Mn2+可以反應生成MnO2,反應離子方程式:2MnO4-+3Mn2++2H2O=5MnO2↓+ 4H+ 。
(4) 根據資料i可知,MnO4-在近中性條件下被還原為MnO2,實驗II中反應結束后溶液pH≈8,接近中性,但生成了MnS。可猜測是因為過量的Na2S與一開始生成的MnO2繼續反應。根據資料ⅱ,單質硫可溶于硫化鈉溶液,溶液呈淡黃色,則Na2S與MnO2反應時,S2-被氧化為S單質,MnO2被還原為Mn2+。若要驗證猜想,只需向MnO2中加入過量Na2S溶液,若溶液呈淡黃色,且生成淺粉色的MnS,即可證明猜想。故可設計實驗方案:將實驗I中生成的MnO2分離洗滌后,加入0.1mol/L Na2S溶液,觀察到有淺粉色沉淀,且溶液呈黃色,證明新生成的MnO2與過量的S2-反應,故沒得到MnO2沉淀。
(5)物質變化還與反應物的濃度或用量有關,反應I中KMnO4溶液過量,濃度較大,反應II中Na2S過量,濃度較大;也與溶液中的酸堿性有關,強酸性溶液時和中性時產物不同。故答案為:濃度、用量、溶液中的酸堿性。


 能考試期末沖刺卷系列答案
能考試期末沖刺卷系列答案科目:高中化學 來源: 題型:
【題目】某氣態烴A,標準狀況下的密度為1.25g/L,B和D都是生活中常見的有機物,D能跟碳酸氫鈉反應,E有香味。它們之間的轉化關系如下圖所示:
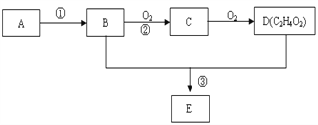
(1)A的電子式為______________,D中官能團的名稱為__________。
(2)以A為原料自身合成高分子化合物的化學方程式為________________。
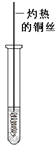
(3)反應②在Cu做催化劑的條件下進行,該實驗的步驟是將紅亮的銅絲置于酒精燈上加熱,待銅絲變為黑色時,迅速將其插入到裝有B的試管中(如右圖所示),重復操作2-3次,觀察到的現象是銅絲由黑色變紅色。 寫出過程②反應方程式 _____________。
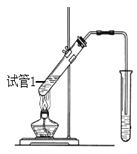
(4)B、D在濃硫酸的作用下實現反應③,實驗裝置如下圖所示:
①試管1中實現反應③的化學方程式為_________________________________。
②反應開始時用酒精燈對試管小火加熱的原因是:_______________________________。(已知乙酸乙酯的沸點為77℃;乙醇的沸點為78.5℃;乙酸的沸點為117.9℃)
查看答案和解析>>
科目:高中化學 來源: 題型:
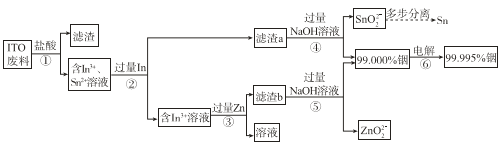
【題目】從廢舊液晶顯示器的主材 ITO(主要成分是含銦、錫的氧化物)回收銦和錫,流程示意圖如下。
資料:
物質 | 銦(In) | 錫(Sn) |
周期表位置 | 第五周期、第IIIA族 | 第五周期、第IVA族 |
顏色、狀態 | 銀白色固體 | 銀白色固體 |
與冷酸作用 | 緩慢反應 | 緩慢反應 |
與強堿溶液 | 不反應 | 反應 |
(1)為了加快步驟①的反應速率,可以采取的措施有______(至少答兩點)。
(2)步驟①中銦的氧化物轉化成In3+的離子方程式是______。
(3)步驟②中加入過量銦能夠除去溶液中的Sn2+,根據所給資料分析其原因是______。
(4)步驟④和⑤中NaOH溶液的作用是______。
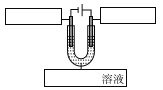
(5)下圖是模擬精煉銦的裝置圖,請在方框中填寫相應的物質。_____
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】高鐵電池是一種新型可充電電池,與普通高能電池相比,該電池長時間保持穩定的放電電壓。高鐵電池的總反應為:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列敘述不正確的是
3Zn(OH)2+2Fe(OH)3+4KOH,下列敘述不正確的是
A. 放電時負極反應為:Zn-2e-+2OH-=Zn(OH)2
B. 充電時陽極反應為:Fe(OH)3-3e-+5OH-=![]() +4H2O
+4H2O
C. 放電時每轉移3 mol電子,正極有1 mol K2FeO4被氧化
D. 放電時正極附近溶液的堿性增強
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期主族元素X、Y、R、M的原子序數依次增大,其中只有R屬于金屬元素,由X、Y、R可組成一種化合物Q,在298K時,0.1mol·L—1 Q溶液的AG(酸度)=lg![]() =-12,由X和M組成的化合物XM是強電解質。下列說法正確的是
=-12,由X和M組成的化合物XM是強電解質。下列說法正確的是
A. Y、R、M三種元素形成的簡單離子半徑:r(M)>r(R)>r(Y)
B. M的氧化物對應的水化物一定是強酸
C. R分別與X、Y、M組成的二元化合物中都含有離子鍵
D. 化合物RYX和RMY均能抑制水的電離
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知氨氣在生活、生產、科研中有極廣泛用途。
(1)已知反應Ⅰ:2NH3(g)+CO2(g)═NH2CO2NH4(s)△H=﹣159.5kJ/mol
反應Ⅱ:NH2CO2NH4(s)═CO(NH2)2 (s)+H2O(g)△H= + 116.5kJ/mol
反應Ⅲ:H2O(l)═H2O(g)△H= + 44.0kJ/mol
工業上以CO2、NH3為原料合成尿素和液態水的熱化學方程式為___________________,該反應在_________條件下可以自發進行(填“高溫”、“低溫”或“任何溫度下”);
(2)查閱資料可知:常溫下,K穩[Ag(NH3)2+]=1.00×107,Ksp[AgCl]=2.50×10﹣10.
①銀氨溶液中存在平衡:Ag+(aq)+2NH3(aq)![]() Ag(NH3)2+ (aq),該反應平衡常數的表達式為K穩=_______________;
Ag(NH3)2+ (aq),該反應平衡常數的表達式為K穩=_______________;
②計算得到可逆反應AgCl (s)+2NH3(aq)![]() Ag(NH3)2+ (aq)+Cl﹣(aq)的化學平衡常數K=_________________________;在1L濃度為1mol/L氨水中最多可以溶解AgCl為_______mol(保留2位有效數字)。
Ag(NH3)2+ (aq)+Cl﹣(aq)的化學平衡常數K=_________________________;在1L濃度為1mol/L氨水中最多可以溶解AgCl為_______mol(保留2位有效數字)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗操作均要用玻璃棒(①過濾;②蒸發;③溶解;④向容量瓶轉移液體),其中玻璃棒的作用及其目的相同的是( )
A.①②
B.①③
C.①④
D.③④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z、W是原子序數依次增大的短周期主族元素。Y的單質經常作為保護氣;由Z、W形成的一種化合物可與X、W形成的化合物反應,生成淡黃色固體。下列推斷正確的是
A. Y的最簡單氫化物的熱穩定性比Z的強
B. 在同周期元素中,W的最高價氧化物對應的水化物的酸性最強
C. 離子半徑:X<Y<Z<W
D. 含W的鹽溶液可能呈堿性
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com