
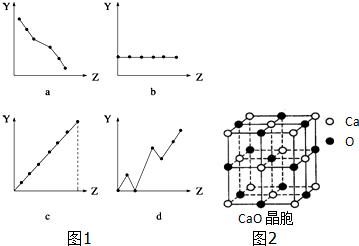
分析 (1)①ⅡA族元素的價電子數均為2;
②第3周期主族元素的最高化合價由+1升高為+7;
(2)元素X、Y、Z、M、N均為短周期主族元素,且原子序數依次增大,Y元素原子最外層電子數與核外電子總數之比為3:4,則最外層電子數為6,核外電子總數為8,故Y為O元素;M元素原子的最外層電子數與電子層數之比為4:3,則電子層數為3,最外層電子數為4,故M為Si,N-、Z+、X+的半徑逐漸減小,XN常溫下為氣體,故N為氯,Z為鈉,X為氫.
③中根據均攤法計算晶胞中鈣原子、氧原子數目,進而計算晶胞質量,再根據V=$\frac{m}{ρ}$計算晶胞體積.
解答 解:(1)①ⅡA族元素的價電子數均為2,隨原子序數的增大而價電子不變,只有b符合,故答案為:b;
②第3周期主族元素的最高化合價由+1升高為+7,只有c符合,故答案為:c;
(2)元素X、Y、Z、M、N均為短周期主族元素,且原子序數依次增大,Y元素原子最外層電子數與核外電子總數之比為3:4,則最外層電子數為6,核外電子總數為8,故Y為O元素;M元素原子的最外層電子數與電子層數之比為4:3,則電子層數為3,最外層電子數為4,故M為Si,N-、Z+、X+的半徑逐漸減小,XN常溫下為氣體,故N為氯,Z為鈉,X為氫.
①由上述五種元素中的任意三種元素組成的強電解質,且兩種物質水溶液的酸堿性相同,組成元素的原子數目之比為1:1:1,A溶液中水的電離程度比B溶液中水的電離程度小,則A為NaOH,B為NaClO,
故答案為:NaClO;
②工業上用焦炭高溫下還原二氧化硅來制備硅,方程式為:SiO2+2C$\frac{\underline{\;高溫\;}}{\;}$Si+2CO,
故答案為:SiO2+2C$\frac{\underline{\;高溫\;}}{\;}$Si+2CO;
③晶胞中鈣原子數目為8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,氧原子數目為1+12×$\frac{1}{4}$=4,故晶胞質量為4×$\frac{56}{{N}_{A}}$g,則晶胞體積為:4×$\frac{56}{{N}_{A}}$g÷a g•cm-3=$\frac{224}{a{N}_{A}}$cm3,
故答案為:$\frac{224}{a{N}_{A}}$cm3.
點評 本題是對物質結構的考查,涉及元素周期律、核外電子排布、無機物推斷、晶胞計算等,是對學生綜合能力的考查,難度中等.


 特高級教師點撥系列答案
特高級教師點撥系列答案科目:高中化學 來源: 題型:選擇題
| A. | 熱穩定性:H2S>HCl>HBr>HI | B. | 熔點:Na2O>MgO>CaO | ||
| C. | 微粒半徑:F-<Na+<Mg2+ | D. | 還原性:H2S>HCl>HF |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | HCl MgCl2 NH4Cl | B. | H2O Na2O CO2 | ||
| C. | CaCl2 NaOH H2S | D. | NH3 H2O CO2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 苯乙烯使溴水褪色;加成反應 | |
| B. | 乙烯水化生成乙醇;取代反應 | |
| C. | 乙醇與CuO加熱反應生成乙醛;氧化反應 | |
| D. | 無水乙醇與濃硫酸加熱到170℃制取乙烯;消去反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鋁的表面容易形成致密的氧化膜,抗腐蝕性能好 | |
| B. | 常溫下不與任何堿反應 | |
| C. | 鋁元素在地殼中的含量高,儲量豐富 | |
| D. | 工業上可以用電解法冶煉鋁 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1.6 | B. | 0.8 | C. | 0.6 | D. | 0.4 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 $\stackrel{KMnO_{4}(H)}{→}$
$\stackrel{KMnO_{4}(H)}{→}$
 $\stackrel{一定條件}{→}$
$\stackrel{一定條件}{→}$  (苯胺,弱堿性,易氧化)
(苯胺,弱堿性,易氧化) .
. .
. .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com