
【題目】某校化學研究性學習小組用濃鹽酸與二氧化錳加熱反應來制取并收集氯氣,裝置如圖: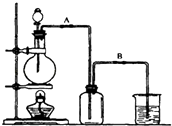
(1)實驗開始前,某學生對裝置進行了氣密性檢查.方法是:連接好裝置后,用彈簧夾夾住處(填“A”或“B“)橡皮管;向分液漏斗中加水并打開活塞,當加到一定量時,停止加水,靜置觀察,當觀察到分液漏斗中時,表明該裝置不漏氣.
(2)上述反應中,若有4molHCl參加反應,轉移的電子的物質的量是mol.
(3)若實驗過程中看到集氣瓶中有黃綠色液滴,說明氯氣具有的性質是 .
【答案】
(1)B,液面高度不再變化
(2)2
(3)易液化
【解析】解:(1)裝置氣密性的檢查:連接好裝置后,用彈簧夾夾住B構成封閉體系,向分液漏斗中加水并打開活塞,漏斗中的液面高度不變,說明氣密性良好,故答案為:B;液面(水面)不下降;
故答案為:B; 液面高度不再變化;
(2)依據方程式MnO2+4HCl(濃) ![]() MnCl2+Cl2↑+2H2O,消耗4mol氯化氫生成1mol氯氣,轉移2mol電子,
MnCl2+Cl2↑+2H2O,消耗4mol氯化氫生成1mol氯氣,轉移2mol電子,
故答案為:2;
(3)實驗過程中看到集氣瓶中有黃綠色液滴,說明氯氣具有的性質是易液化,
故答案為:易液化.
(1)根判斷裝置氣密性的操作方法進行回答;
(2)依據方程式計算轉移電子數;
(3)氯氣沸點高,易液化.


科目:高中化學 來源: 題型:
【題目】現使用酸堿中和滴定法測定市售白醋的總酸量(g100mL﹣1).
(1)實驗步驟
①用(填儀器名稱)量取10.00mL食用白醋,在燒杯中用水稀釋后轉移到100mL(填儀器名稱)中定容,搖勻即得待測白醋溶液.
②用酸式滴定管取待測白醋溶液20.00mL于錐形瓶中,向其中滴加2滴作指示劑.
③讀取盛裝0.100 0molL﹣1 NaOH 溶液的堿式滴定管的初始讀數.如果液面位置如圖所示,則此時的讀數為mL.![]()
④滴定.當時,
停止滴定,并記錄NaOH溶液的終讀數.重復滴定3次.
(2)實驗記錄
滴定次數實驗數據(mL) | 1 | 2 | 3 | 4 |
V(樣品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
數據處理與討論
①按實驗所得數據,可得c(市售白醋)=molL﹣1(列式計算);市售白醋總酸量=g100mL﹣1(列式計算).
②在本實驗的滴定過程中,下列操作會使實驗結果偏大的是填寫序號).
a.堿式滴定管在滴定時未用標準NaOH溶液潤洗
b.堿式滴定管的尖嘴在滴定前有氣泡,滴定后氣泡消失
c.錐形瓶中加入待測白醋溶液后,再加少量水
d.錐形瓶在滴定時劇烈搖動,有少量液體濺出.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將3molO2加入到VL的反應器中,在高溫下放電,經t1s建立了平衡體系:3O22O3 , 此時測知O2的轉化率為30%,下列圖象能正確表示氣體的物質的量濃度(m)跟時間(t)的關系的是( )
A.
B.
C.
D.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示,在一個容積固定的恒溫容器中,有兩個可左右滑動的密封隔板,在C,A處充入等質量的X、Y兩種氣體,且X、Y的氣體密度相等.當隔板停止滑動時,下列說法一定正確的是( )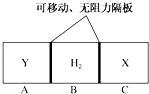
A.X、Y均為氣體單質
B.物質的量:n(X)<n(H2)<n(Y)
C.X的相對分子質量等于Y的相對分子質量
D.隔板停止滑動時,A,B,C三部分體積相等
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(多選)短周期元素R,T,Q,W在元素周期表中的相對位置如圖所示,其中Q單質可制成半導體材料.下列判斷正確的是( ) 
A.W形成的離子半徑大于T形成的離子半徑
B.W的單質在過量氧氣中燃燒生成WO3
C.最高價氧化物的水化物的酸性:R<Q
D.T是地殼中含量最多的金屬元素,其單質的化學性質較活潑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗中欲快速制得H2,以下最合適的方法是()
A. 純鋅與稀H2SO4 B. 純鋅和濃H2SO4
C. 純鋅與稀鹽酸 D. 粗鋅(含銅雜質)與稀H2SO4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列化學實驗操作或事故處理方法錯誤的是
A. 不慎將酸濺到眼中,應立即用水沖洗,邊洗邊眨眼睛
B. 不慎將濃堿溶液沾到皮膚上,要立即用大量水沖洗,然后涂上硼酸
C. 酒精燈著火時可用濕抹布蓋滅
D. 配制硫酸溶液時,可先在量筒中加入一定體積的水,再在攪拌條件下慢慢加入濃硫酸
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,關于溶液的稀釋下列說法正確的是( )
A.pH=3的醋酸溶液稀釋100倍,pH=5
B.pH=4的H2SO4溶液加水稀釋100倍,溶液中由水電離產生的c(H+)=1×10﹣6 molL﹣1
C.將1L 0.1molL﹣1的Ba(OH)2溶液稀釋為2L,pH=13
D.pH=8的NaOH溶液稀釋100倍,其pH=6
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃,將0.4mol/L CH3COOH 溶液和 0.2mol/L NaOH 溶液各 100mL 混合后,pH=5,(設混合后溶液總體積為兩溶液體積之和)
(1)混合溶液中離子濃度由大到小的順序是
(2)①c(CH3COO﹣)+c(CH3COOH)= mol/L②c(CH3COO﹣)﹣c(CH3COOH)= mol/L.
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com