
分析 (1)依據熱化學方程式和蓋斯定律計算得到所需讓化學方程式;
(2)先將MgCl2•6H20轉化為MgCl2•NH4Cl•nNH3,然后在700℃脫氨得到無水氯化鎂,依據原子守恒書寫化學方程式;用惰性電極電解熔融氯化鎂,陰極上是鎂離子得到電子生成鎂;
(3)氧化還原反應電子轉移守恒計算.
解答 解:(1)①Mg(s)+H2(g)═MgH2(s)△H1=-74.5kJ•mol-1
②Mg2Ni(s)+2H2(g)═Mg2NiH4(s)△H2=-64.4kJ•mol-1
Mg2Ni(s)+2MgH2(s)═2Mg(s)+Mg2NiH4(s)△H3
由蓋斯定律②-2×①得到Mg2Ni(s)+2MgH2(s)═2Mg(s)+Mg2NiH4(s)△H3=-64.4KJ/mol-2×(-74.5KJ/mol)=+84.6kJ/mol,則△H3=+84.6kJ/mol,
故答案為:+84.6;
(2)MgCl2•NH4Cl•nNH3,在700℃脫氨得到無水氯化鎂,反應的化學方程式:MgCl2•NH4Cl•nNH3$\frac{\underline{\;700℃\;}}{\;}$MgCl2+(n+1)NH3↑+HCl↑;用惰性電極電解熔融氯化鎂,陰極上是鎂離子得到電子生成鎂,電極反應為:Mg2++2e-=Mg;
故答案為:MgCl2•NH4Cl•nNH3$\frac{\underline{\;700℃\;}}{\;}$MgCl2+(n+1)NH3↑+HCl↑;Mg2++2e-=Mg;
(3)儲氫材料Mg(AlH4)2在110℃-200℃的反應為:Mg(AlH4)2=MgH2+2Al+3H2↑,反應中生成2molAl轉移電子6mol,每生成27gAl轉移電子的物質的量為3mol,
故答案為:3mol.
點評 本題考查了金屬單質及其化合物的綜合應用、熱化學方程式的書寫等知識,試題知識點較多、綜合性較強,充分考查了學生的分析、理解能力及靈活應用所學知識的能力,注意掌握蓋斯定律的概念及應用方法.


科目:高中化學 來源: 題型:選擇題
| 方案 | 操作 | 判斷 |
| A | 分別加入澄清石灰水 | 產生沉淀者為Na2CO3 |
| B | 分別加入等濃度的稀鹽酸 | 反應較劇烈者為Na2CO3 |
| C | 分別加入CaCl2溶液 | 產生沉淀者為Na2CO3 |
| D | 逐漸加入等濃度的鹽酸 | 立即產生氣泡者為Na2CO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
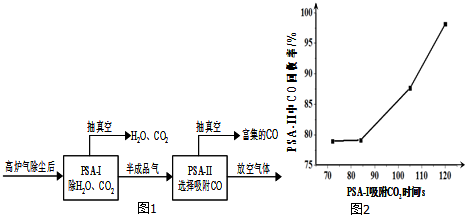
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
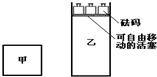 一定溫度下,有可逆反應:2A(g)+2B(g)?C(g)+3D(g)△H<0.現將2 mol A和2 mol B充入體積為V的甲容器,將2 mol C和6 mol D充入乙容器并使乙容器在反應開始前的體積為2V(如圖).關于兩容器中反應的說法正確的是( )
一定溫度下,有可逆反應:2A(g)+2B(g)?C(g)+3D(g)△H<0.現將2 mol A和2 mol B充入體積為V的甲容器,將2 mol C和6 mol D充入乙容器并使乙容器在反應開始前的體積為2V(如圖).關于兩容器中反應的說法正確的是( )| A. | 兩容器達平衡后升高相同的溫度時,甲容器的反應速率大于乙容器的速率 | |
| B. | 兩容器中的反應均達平衡時,平衡混合物中各組份的體積百分組成相同,混合氣體的密度不同 | |
| C. | 甲容器中的反應先達到化學平衡狀態 | |
| D. | 在甲容器中再充入2 mol A和2 mol B,平衡后甲中物質C的物質的量是乙中物質C的物質的量的2倍 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
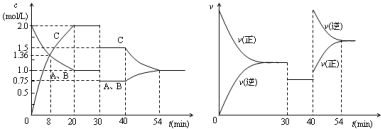
| A. | 30min時降低溫度,40min時升高溫度 | |
| B. | 8min前A的平均反應速率為0.17mol/(L•min) | |
| C. | 反應方程式中的x=1,正反應為放熱反應 | |
| D. | 20min~40min間該反應的平衡常數均為4 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 至少存在5種離子 | |
| B. | Cl-一定存在,且c(Cl-)≥0.2mol/L | |
| C. | SO42-、NH4+、Fe3+一定存在,Al3+、K+、Cl-可能存在 | |
| D. | CO32-一定不存在,SO42-、NH4+、Fe3+、Cl-一定存在 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
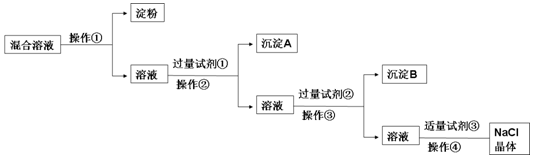
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com