
【題目】硝酸是一種重要的化工原料,用來制取一系列硝酸鹽類氮肥,如硝酸銨、硝酸鉀等;也用來制取含硝基的炸藥等。試回答下列問題:
(1)某同學對鐵與稀硝酸的反應進行探究,若HNO3只被還原成NO,則:
①寫出鐵與過量稀硝酸反應的離子方程式:__。
②寫出過量鐵與稀硝酸反應的離子方程式:__。
③若28g鐵與含1.6mol硝酸的稀硝酸恰好完全反應,則生成的Fe3+和Fe2+的物質的量之比為__。上述反應結束后,向反應后的溶液中加足量氫氧化鈉溶液,濾出沉淀洗滌后,在空氣中灼燒至質量不變,最終得到的固體質量為__g。
(2)飲用水中NO3-對人類健康會產生危害,為了降低飲用水中NO3-的濃度,某飲用水研究人員提出,可在堿性條件下用鋁粉將NO3-還原為N2。
①配平方程式:__Al+__NO3-+__OH-+__=__[Al(OH)4]-+__N2↑。
②上述反應中,還原劑與還原產物的物質的量之比是__,反應中轉移電子0.3mol,生成__mL(標準狀況下)N2。
【答案】Fe+NO3-+4H+=Fe3++NO↑+2H2O 3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O 2∶3 40 10 6 4 18H2O 10 3 10∶3 672
【解析】
(1)①鐵與過量稀硝酸反應生成硝酸鐵、NO和水,離子方程式為Fe+NO3-+4H+=Fe3++NO↑+2H2O;
②過量鐵與稀硝酸反應生成硝酸亞鐵、NO和水,離子方程式為3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O;
③28g鐵的物質的量為0.5mol,與含1.6mol硝酸的稀硝酸恰好完全反應,設生成的Fe3+和Fe2+的物質的量分別是xmol、ymol,即生成xmol硝酸鐵和ymol硝酸亞鐵,根據N原子守恒知,生成NO的物質的量為(1.6-3x-2y)mol,根據得失電子守恒有3x+2y=3(1.6-3x-2y),又有x+y=0.5,解得x=0.2,y=0.3,則生成的Fe3+和Fe2+的物質的量之比為2∶3;上述反應結束后,向反應后的溶液中加足量氫氧化鈉溶液,濾出沉淀洗滌后,在空氣中灼燒至質量不變,由于生成的氫氧化亞鐵在空氣中易被氧化為氫氧化鐵,氫氧化鐵受熱分解最終得到的固體是氧化鐵,故其物質的量為0.5mol×![]() =0.25mol,質量為40g;
=0.25mol,質量為40g;
(2)①根據得失電子守恒、原子守恒及電荷守恒,可知離子方程式為10Al+6NO3-+4OH-+18H2O=10[Al(OH)4]-+3N2↑;
②上述反應中,還原劑是Al,還原產物是N2,其物質的量之比為10∶3;由方程式可知,生成3molN2時轉移電子30mol,所以反應中轉移電子0.3mol,生成N2的體積(標準狀況下)為![]() ×22.4L·mol-1=0.672L=672mL。
×22.4L·mol-1=0.672L=672mL。
【點睛】
金屬與硝酸反應的計算一般常采用以下方法:①原子守恒法:HNO3與金屬反應時,一部分HNO3起酸的作用,以NO的形式存在于溶液中;一部分作為氧化劑轉化為還原產物,這兩部分中氮原子的總物質的量等于反應消耗的HNO3中氮原子的物質的量;②得失電子守恒法:HNO3與金屬的反應屬于氧化還原反應,HNO3中氮原子得到電子的物質的量等于金屬失電子的物質的量;③電荷守恒法:HNO3過量時反應后溶液中(不考慮OH-)有:c(NO3-)=c(H+)+nc(Mn+)(Mn+代表金屬離子);④離子方程式計算法:金屬與H2SO4、HNO3的混合酸反應時,由于溶液中NO3-在H2SO4提供H+的條件下能繼續與金屬反應,因此此類題目應用離子方程式來計算,先作過量判斷,然后根據完全反應的金屬或H+或NO3-進行相關計算,且溶液中要符合電荷守恒。
【題型】綜合題
【結束】
21
【題目】如圖是氮元素的幾種價態與物質類別的對應關系。請回答下列問題:

(1)寫出N2的一種用途:___。
(2)HNO3與圖中的物質C
(3)實驗室制取物質B的化學方程式為____。
(4)NO2與水反應生成物質A的化學方程式為____。
(5)濃硝酸與木炭在加熱條件下反應的化學方程式為___。
【答案】做保護氣(或做冷凍劑、制氨氣等) AgNO3 Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O 3NO2+H2O===2HNO3+NO 4HNO3(濃)+C
CaCl2+2NH3↑+2H2O 3NO2+H2O===2HNO3+NO 4HNO3(濃)+C![]() CO2↑+4NO2↑+2H2O
CO2↑+4NO2↑+2H2O
【解析】
(1)由于氮氣的化學性質不活潑,所以可做保護氣,也可做冷凍劑、制氨氣等;
(2)檢驗Cl-的方法是先向待測液中加入硝酸酸化,再滴加AgNO3溶液,若產生白色沉淀,則證明待測液中含有Cl-,因此C為AgNO3;
(3)B是NH3,在實驗室中用銨鹽與堿共熱來制取NH3,化學方程式為Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
(4)A是NO,NO2與水反應生成NO的化學方程式為3NO2+H2O=2HNO3+NO;
(5)濃硝酸有強氧化性,與木炭在加熱條件下發生反應生成CO2、NO2和H2O,反應的化學方程式為4HNO3(濃)+C![]() CO2↑+4NO2↑+2H2O;
CO2↑+4NO2↑+2H2O;


 課課練江蘇系列答案
課課練江蘇系列答案 名牌中學課時作業系列答案
名牌中學課時作業系列答案 明天教育課時特訓系列答案
明天教育課時特訓系列答案 浙江新課程三維目標測評課時特訓系列答案
浙江新課程三維目標測評課時特訓系列答案科目:高中化學 來源: 題型:
【題目】在下列反應中,反應物中每個原子都參加氧化還原反應的是( )
A.2KNO3+3C+S![]() K2S+N2↑+3CO2↑
K2S+N2↑+3CO2↑
B.2NaCl![]() 2Na+Cl2↑
2Na+Cl2↑
C.2AgNO3![]() 2Ag+2NO2↑+O2↑
2Ag+2NO2↑+O2↑
D.2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】早在古代,我國人民就積累了不少對化學物質變化的認識。例如,晉代煉丹家、醫學家葛洪所著《抱樸子》一書中記載有“丹砂燒之成水銀,積變又還成丹砂”。這句話中的丹砂指的是HgS,下列有關說法正確的是( )
A.這個過程只涉及物理變化
B.“積變又還成丹砂”過程中發生反應:HgS![]() Hg+S
Hg+S
C.實驗室中不慎灑落的水銀不能用硫黃處理
D.“丹砂燒之成水銀”過程中還可能產生SO2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室測定鉻鐵礦中鉻(Cr)含量的步驟如下:
步驟1:準確稱取0.2000g鉻鐵礦試樣放入錐形瓶中,加入適量磷酸和硫酸的混合酸,加熱使試樣完全溶解,冷卻。
步驟2:向上述溶液中滴加5滴1%MnSO4溶液,再加入一定量的(NH4)2S2O8溶液,搖勻至溶液呈紫紅色[先后發生Cr3+![]() Cr2O72-、Mn2+
Cr2O72-、Mn2+![]() MnO4-]。
MnO4-]。
步驟3:上述溶液加熱煮沸至紫紅色褪去[除去過量的(NH4)2S2O8和生成的MnO4-],冷卻。
步驟4:用0.2000mol·L-1(NH4)2Fe(SO4)2標準溶液滴定上述溶液至終點(發生Cr2O72-![]() Cr3+),消耗19.50mL標準溶液。
Cr3+),消耗19.50mL標準溶液。
(1)(NH4)2S2O8中陰離子的結構如圖所示。從結構分析,(NH4)2S2O8置于棕色試劑瓶并于陰涼處保存的原因是__。
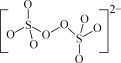
(2)“步驟2”中加入5滴1%MnSO4溶液的目的是__。
(3)“步驟3”中,如果繼續加熱煮沸時間不充足,會使鉻含量的測定結果___(填“偏大”“不變”或“偏小”)。
(4)計算鉻鐵礦中鉻的質量分數___(寫出計算過程)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】從八角茴香中提取的莽草酸,是合成治療禽流感的藥物——達菲( Tamiflu) 的原料之一。其結構簡式如圖,下列有關莽草酸分子的說法正確的是
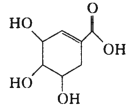
A.含有兩種不同的官能團
B.7個碳原子共面
C.1mol能與4molNaOH 完全反應
D.既能使 Br2的CCl4溶液褪色 ,又能使酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以含鈷廢催化劑(主要成分為Co、Fe、SiO2)為原料制取復合氧化鈷的流程如下:
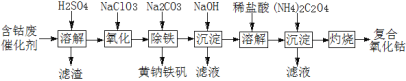
(1)用H2SO4溶解后過濾,得到的濾渣是____(填化學式)。將濾渣洗滌2~3次,再將洗液與濾液合并的目的是____。
(2)在加熱攪拌條件下加入NaClO3,將Fe2+氧化成Fe3+,反應的離子方程式是____。
(3)已知:鐵氰化鉀的化學式為K3[Fe(CN)6];亞鐵氰化鉀的化學式為K4[Fe(CN)6]。
3Fe2++2[Fe(CN)6]3 =Fe3[Fe(CN)6]2↓(藍色沉淀)
4Fe3++3[Fe(CN)6]4 =Fe4[Fe(CN)6]3↓(藍色沉淀)
確定Fe2+是否氧化完全的方法是____。(僅供選擇的試劑:鐵氰化鉀溶液、亞鐵氰化鉀溶液、鐵粉、KSCN溶液)
(4)向氧化后的溶液中加入適量的Na2CO3調節酸度,使之生成黃鈉鐵礬[Na2Fe6(SO4)4(OH)12]沉淀,寫出該反應的離子方程式:____。
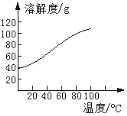
(5)已知CoCl2的溶解度曲線如圖所示。向堿式碳酸鈷沉淀中加入足量稀鹽酸邊加熱邊攪拌至完全溶解后,需趁熱過濾的原因是____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃時,用 0.1molL-1NaOH溶液滴定 20 mL 0.1 molL-1 某二元弱酸 H2A ( Ka1 =1.1×10-3,Ka2= 3.9×10-6 )溶液,滴定過程中溶液的 pH 變化曲線如圖所示。下列說法正確的是
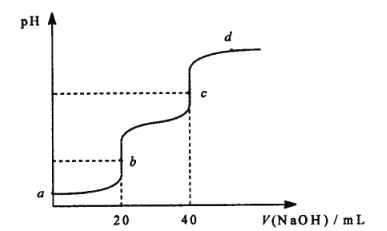
A.a 點的pH 大于2
B.b 點溶液中c(H2A) > c(A2-)
C.c 點溶液中c( HA-) + 2c(H2A ) = c( OH- )-c(H+)
D.d 點溶液中c (Na+) +c(H+) =c(A2-) +c(HA-) +c(OH-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子方程式,書寫正確的是( )
A.鹽酸與石灰石反應:CO32ˉ+2H+ = CO2↑+H2O
B.鐵與稀鹽酸反應:2Fe+6H+ = 2Fe3++3H2↑
C.氫氧化鐵膠體的制備:FeCl3 + 3H2O = Fe(OH)3+3HCl
D.硫酸銅溶液中滴加氫氧化鋇溶液:Ba2++2OH-+Cu2++SO42ˉ = BaSO4↓+Cu(OH)2↓
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定量的CO2與足量的碳在體積可變的恒壓密閉容器中反應:C(s)+CO2(g)![]() 2CO(g)。平衡時,體系中氣體體積分數與溫度的關系如下圖所示:
2CO(g)。平衡時,體系中氣體體積分數與溫度的關系如下圖所示:

已知:氣體分壓(P分)=氣體總壓(P總)×體積分數。下列說法正確的是
A. 550℃時,若充入惰性氣體,正,逆 均減小,平衡不移動
B. 650℃時,反應達平衡后CO2的轉化率為25.0%
C. T℃時,若充入等體積的CO2和CO,平衡向逆反應方向移動
D. 925℃時,用平衡分壓代替平衡濃度表示的化學平衡常數KP=24.0P總
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com