
【題目】Ⅰ、鐵能形成多種價態的化合物,單質鐵能被眾多的氧化劑所氧化。
(1)將5.6g的生鐵與足量的稀鹽酸反應,生成H2的質量______0.2g(填“>”“<”“=”),向此生鐵上滴加幾滴稀硝酸,寫出反應的離子方程式:___________________________。
(2)配制FeCl3溶液時常會出現渾濁現象,其原因是______________________(用離子方程式表示)。室溫下配制5mol/L 200mL FeCl3溶液,至少需要添加_______mL 2mol/L的鹽酸才會不出現渾濁(已知室溫時Ksp[Fe(OH)3]=4.0×10-38,忽略加入鹽酸對溶液體積的影響)。
(3)鋼鐵制品易生銹,導致其生銹的最主要原因是發生了________腐蝕;用NaOH、NaNO2等溶液對鐵制品進行鈍化處理可提高其抗腐蝕能力,下面是處理過程中所發生的一個反應:____Na2FeO2+_____NaNO2+_____H2O===_____Na2Fe2O4+_____NH3↑+_____,請完善該反應方程式。
II、硝化法是一種古老的生產硫酸的方法,同時實現了氮氧化物的循環轉化,主要反應為
NO2(g)+SO2(g)![]() SO3(g)+NO(g)△H=-41.8kJ·mol-1
SO3(g)+NO(g)△H=-41.8kJ·mol-1
(1)下列說法中可以說明該反應已達到平衡狀態的是_________。
a. 體系內混合氣體的密度保持不變 b. ![]()
c. 容器內氣體的總壓強保持不變 d. NO體積分數不再改變
(2)某溫度下,NO2(g)+SO2(g)![]() SO3(g)+NO(g)的平衡常數k=2.25,該溫度下在甲、乙、丙三個體積為2L的恒容密閉容器中,投入NO2(g)和SO2(g),其起始濃度如下表所示。
SO3(g)+NO(g)的平衡常數k=2.25,該溫度下在甲、乙、丙三個體積為2L的恒容密閉容器中,投入NO2(g)和SO2(g),其起始濃度如下表所示。
起始濃度 | 甲 | 乙 | 丙 |
c(NO2)/mol/L | 0.10 | 0.20 | 0.20 |
c(SO2)/mol/L | 0.10 | 0.10 | 0.20 |
①10min后,甲中達到平衡,則甲中反應的平均速率![]() ___________。
___________。
②丙達到平衡所用的時間_________(填“<”“>”“=”)10min,達到平衡后,設甲、乙、丙中SO2(g)的轉化率分別為a、b、c,則三者的大小關系為_________。
【答案】 < ![]() Fe3++3H2O
Fe3++3H2O![]() Fe(OH)3+3H+ 5 吸氧 6、1、5、3、1、7 NaOH bd 0.006mol/(L.min) < a=c<b
Fe(OH)3+3H+ 5 吸氧 6、1、5、3、1、7 NaOH bd 0.006mol/(L.min) < a=c<b
【解析】Ⅰ、(1)將5.6g的生鐵與足量的稀鹽酸反應,因生鐵中含有碳,實際Fe的質量小于5.6g,則生成H2的質量<0.2g;過量鐵溶解于少量稀硝酸生成硝酸亞鐵和NO,此反應的離子方程式為 ;3Fe+8H++2NO3- =3Fe2++2NO↑+4H2O;
(2)因Fe3+易水解,水解反應式為Fe3++3H2O![]() Fe(OH)3+3H+,則配制FeCl3溶液時常會出現渾濁現象;若不出現渾濁現象,則c(Fe3+)×C3(OH-)≤Ksp[Fe(OH)3],代入有關數據后可求出c(OH-)≤2×10-13mol/L,c(H+)≥0.05mol/L,則加入鹽酸的體積至少為
Fe(OH)3+3H+,則配制FeCl3溶液時常會出現渾濁現象;若不出現渾濁現象,則c(Fe3+)×C3(OH-)≤Ksp[Fe(OH)3],代入有關數據后可求出c(OH-)≤2×10-13mol/L,c(H+)≥0.05mol/L,則加入鹽酸的體積至少為![]() =0.005L=5mL;
=0.005L=5mL;
(3)鋼鐵是合金,易發生吸氧腐蝕;在此氧化還原反應中,Na2FeO2化合價由+2價升為Na2Fe2O4的+3價,當2molNa2FeO2參與反應時,失去2mol電子;NaNO2做氧化劑,化合價由+3價將為NH3的-3價,當1molNaNO2參與反應時,失去6mol電子,根據得失電子數守恒可知,Na2FeO2的計量數為6,Na2Fe2O4的計量數為3,NaNO2的計量數為1,NH3的計量數為1,然后根據質量守恒可知,H2O的計量數為5,NaOH的計量數為7,反應為6Na2FeO2+NaNO2+5H2O═3Na2Fe2O4+NH3↑+7NaOH;
II、(1)a.混合氣體的質量和體積不變,密度始終不變,無法判斷是平衡狀態,故a錯誤;b. ![]() 是平衡狀態,故b正確;c.混合氣體的總物質的量不變,體積不變,容器內壓強始終不變,無法判斷是平衡狀態,故c錯誤;d.NO體積分數不再改變,量不變,是平衡狀態,故d正確;答案為bd;
是平衡狀態,故b正確;c.混合氣體的總物質的量不變,體積不變,容器內壓強始終不變,無法判斷是平衡狀態,故c錯誤;d.NO體積分數不再改變,量不變,是平衡狀態,故d正確;答案為bd;
(2)①根據反應中NO2(g)和SO2(g)的起始濃度分別為0.1mol/L,設在10min達到平衡時,NO2濃度的該變量為x,根據三段式可知:
NO2(g)+SO2(g)SO3(g)+NO(g)
初始(mol/L):0.10.1 00
△C:x xxx
平衡:0.1-x0.1-x x x
根據平衡常數為![]() 可知:
可知: ![]() =
=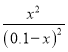 解得x=0.06mol/L.
解得x=0.06mol/L.
則平均速率v(NO2)= ![]() =0.006mol/(Lmin);
=0.006mol/(Lmin);
②由于容器體積相同,且反應為氣體體積不變的反應,故按照等加料,達到的是等效平衡,故甲和丙為等效平衡,即丙中所達的平衡狀態和甲相同,而由于丙中反應物的濃度大于甲,故反應速率比甲快,到達平衡的時間比10min短;由于甲和丙為等效平衡,故甲、丙中SO2(g)的轉化率相等,而乙相當于是向甲容器中加入NO2,據故SO2的轉化率大于甲,故三個容器中的轉化率的關系為a=c<b。


科目:高中化學 來源: 題型:
【題目】I.可以由下列反應合成三聚氰胺:CaO+3C![]() CaC2+CO, CaC2+N2
CaC2+CO, CaC2+N2![]() CaCN2+C,CaCN2+2H2O=NH2CN+Ca(OH)2,NH2CN與水反應生成尿素[CO(NH2)2],尿素合成三聚氰胺。
CaCN2+C,CaCN2+2H2O=NH2CN+Ca(OH)2,NH2CN與水反應生成尿素[CO(NH2)2],尿素合成三聚氰胺。
(1)CaCN2中陰離子為CN22-,與CN22-互為等電子體的分子有N2O和_____(填化學式), 由此可以推知CN22-的空間構型為_______。
(2)三聚氰胺( )俗稱“蛋白精”。動物攝入三聚氰胺和三聚氰酸(
)俗稱“蛋白精”。動物攝入三聚氰胺和三聚氰酸(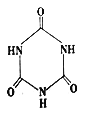 )
)
后,三聚氰酸與三聚氰胺分子相互之間通過______結合,在腎臟內易形成結石。
II.碳元素形成的單質具有平面層狀結構,同一層中的原子構成許許多多的正六邊形,此單質與熔觸的鉀相互作用,形成某種青銅色的物質(其中的元素鉀用“●”表示),原子分布如圖所示,該物質的化學式為_________。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在下列四只試管中分別加入一些物質,甲試管:豆漿;乙試管:氨基酸溶液;丙試管:牛奶和蛋白酶;丁試管:蛋清。上述四支試管中加入雙縮脲試劑振蕩后,有紫色反應的是
A. 甲乙 B. 甲乙丁 C. 甲乙丙 D. 甲丙丁
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關實驗操作的敘述錯誤的是( )
A. 過濾操作中,漏斗的尖端應接觸燒杯內壁
B. 從滴瓶中取用試劑時,滴管的尖嘴可以接觸試管內壁
C. 滴定接近終點時,滴定管的尖嘴可以接觸錐形瓶內壁
D. 向容量瓶轉移液體時,導流用玻璃棒可以接觸容量瓶內壁
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】測得某溶液中僅含Cu2+、K+、SO42-、Cl-四種離子,且陽離子的數量比為Cu2+:K+=3:4,則SO42-:Cl-的比值可能是
A. 3:2 B. 2:1 C. 1:8 D. 任意比
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com