
【題目】根據反應4NH3+5O2=4NO+6H2O,回答下列問題:
(1)該反應中氧化劑是_______________,被氧化的是_________元素。
(2)該反應中氧化劑與還原劑的物質的量之比為______________。
(3)若反應中轉移了10mol電子,則生成的NO在標準狀況下的體積為_________。
(4)用單線橋法標出電子轉移的方向與數目 ____________。
【答案】O2, N 5:4 44.8L ![]()
【解析】
(1)該反應中氮元素的化合價從-3價升高到+2價,氧元素的化合價從0價降低到-2價,因此氧化劑是![]() ,被氧化的是氮元素;
,被氧化的是氮元素;
(2)![]() 中的氮元素化合價全部升高,
中的氮元素化合價全部升高,![]() 中的氧元素的化合價全部降低,因此氧化劑和還原劑的物質的量之比就是其化學計量數之比,即5:4;
中的氧元素的化合價全部降低,因此氧化劑和還原劑的物質的量之比就是其化學計量數之比,即5:4;
(3)由反應方程式可以看出,當生成4mol![]() 時,一共轉移了5mol×4=20mol電子,也就是說生成
時,一共轉移了5mol×4=20mol電子,也就是說生成![]() 數和轉移電子數為1:5,故當轉移10mol電子時可以生成2mol
數和轉移電子數為1:5,故當轉移10mol電子時可以生成2mol![]() ,
,![]() 在標況下的體積為22.4L/mol×2mol=44.8L;
在標況下的體積為22.4L/mol×2mol=44.8L;
(4)單線橋即從失電子的物質指向得電子的物質,由上一問可知一共轉移了20個電子,據此畫出單線橋:![]() 。
。


 一諾書業暑假作業快樂假期云南美術出版社系列答案
一諾書業暑假作業快樂假期云南美術出版社系列答案科目:高中化學 來源: 題型:
【題目】下列事實中,不能用勒夏特列原理解釋的是
①Fe(SCN)3溶液中加入固體KSCN后顏色變深②向稀鹽酸中加入少量蒸餾水,鹽酸中氫離子濃度降低 ③實驗室常用排飽和食鹽水的方法收集氯氣 ④棕紅色NO2加壓后顏色先變深后變淺 ⑤加入催化劑有利于合成氨的反應 ⑥由H2(g)、I2(g)和HI(g)組成的平衡體系加壓后顏色變深 ⑦500℃時比室溫更有利于合成氨的反應 ⑧將混合氣體中的氨液化有利于合成氨反應
A. ①②⑥⑧B. ①③⑤⑦C. ②⑤⑥⑦D. ②③⑦⑧
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列化學實驗設計正確的是
A.稀![]() 與Cu反應產生的氣體可用NaOH溶液完全吸收
與Cu反應產生的氣體可用NaOH溶液完全吸收
B.將![]() 通人含有碳酸鈣的水中制取較高濃度的次氯酸溶液
通人含有碳酸鈣的水中制取較高濃度的次氯酸溶液
C.變色硅膠干燥劑含有![]() ,干燥劑呈藍色時,表示不具有吸水干燥功能
,干燥劑呈藍色時,表示不具有吸水干燥功能
D.探究![]() 濃度對化學反應速率的影響:取兩只試管,分別加入
濃度對化學反應速率的影響:取兩只試管,分別加入![]() 酸性溶液,然后向一只試管中加入
酸性溶液,然后向一只試管中加入![]() 溶液2mL,向另一只試管中加入
溶液2mL,向另一只試管中加入![]() 溶液4mL,比較兩支試管褪色的時間
溶液4mL,比較兩支試管褪色的時間
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】“低碳循環”引起各國的高度重視,而如何降低大氣中![]() 的的含量及有效地開發利用
的的含量及有效地開發利用![]() ,也正成為科學家研究的主要課題。利用
,也正成為科學家研究的主要課題。利用![]() 直接加氫合成二甲醚包括以下三個相互聯系的反應。
直接加氫合成二甲醚包括以下三個相互聯系的反應。
I甲醇的合成![]()
II甲醇脫水![]()
Ⅲ逆水汽變換![]()
已知:相關物質變化的焓變示意圖如下:
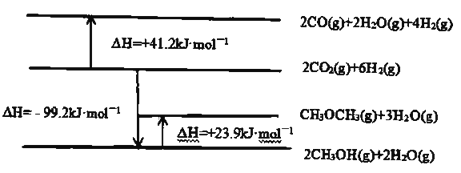
(1)請寫出![]() 直接加氫合成二甲醚的熱化學方程式:________________。
直接加氫合成二甲醚的熱化學方程式:________________。
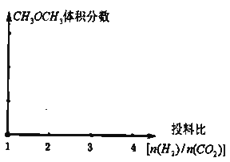
(2)保持恒溫恒容的條件,當a充入![]() 、b充入
、b充入![]() ,在其他條件不變時,請在下圖中分別畫出平衡時
,在其他條件不變時,請在下圖中分別畫出平衡時![]() 的體積分數隨投料比
的體積分數隨投料比![]() 變化的曲線圖,請用a、b標注曲線圖。_________
變化的曲線圖,請用a、b標注曲線圖。_________
(3)在恒容密閉容器里按體積比為![]() 充入二氧化碳和氫氣,一定條件下反應達到平衡狀態。當改變反應的某一個條件后,下列變化能說明平衡一定向逆反應方向移動的是________________。
充入二氧化碳和氫氣,一定條件下反應達到平衡狀態。當改變反應的某一個條件后,下列變化能說明平衡一定向逆反應方向移動的是________________。
A.正反應速率先增大后減小
B.逆反應速率先增大后減小
C.化學平衡常數K值增大
D.反應物的體積分數增大
(4)溫度、壓強對反應中![]() 平衡轉化率和二甲醚的選擇性的影響如下圖1,圖2:
平衡轉化率和二甲醚的選擇性的影響如下圖1,圖2:
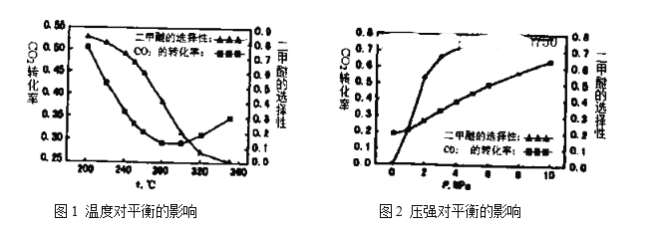
①根據圖1,下列說法正確的是________。
A.溫度較高時,反應以逆水汽變換反應為主,溫度升高,反應速率加快,所以![]() 轉化率增大
轉化率增大
B.溫度較低時,反應以合成二甲醚為主,正反應放熱,升高溫度,![]() 平衡轉化率降低
平衡轉化率降低
C.由圖像可知,![]() 加氫合成二甲醚應該選擇具有良好的低溫活性的催化劑
加氫合成二甲醚應該選擇具有良好的低溫活性的催化劑
D.由圖像可知,高溫有利于逆水汽變換反應,而不利于二甲醚的生成
②根據圖2可知:隨著壓強升高,![]() 平衡轉化率和二甲醚的選擇性都增大,分析原因:__________。
平衡轉化率和二甲醚的選擇性都增大,分析原因:__________。
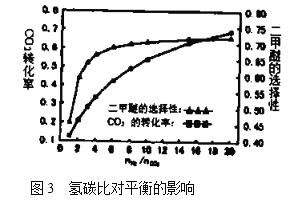
(5)在![]() ,壓強為3.0MPa的反應條件下,氫碳比
,壓強為3.0MPa的反應條件下,氫碳比![]() 對
對![]() 轉化率和二甲醚選擇性的影響見圖3.分析實際工業生產中制備二甲醚選擇氫碳比在3~6之間的原因:________________。
轉化率和二甲醚選擇性的影響見圖3.分析實際工業生產中制備二甲醚選擇氫碳比在3~6之間的原因:________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鉛及其化合物用途廣泛,三鹽基硫酸鉛(3PbO·PbSO4·H2O,摩爾質量=990 g/mol)簡稱三鹽。以鉛泥(主要成分為PbO、Pb及PbSO4等)為原料制備三鹽的工藝流程如圖所示。

已知:![]() 。
。
請回答下列問題:
(1)步驟①中涉及的主要反應的平衡常數K=____(列出計算式即可)。步驟②中濾渣的主要成分是____。
(2)步驟③酸溶時,為提高酸溶速率,可采取的措施是____(任答一條)。
(3)步驟⑥合成三鹽的化學方程式為____。現用100 t鉛泥可制得純凈干燥的三鹽49.5 t,若鉛元素的利用率為75%,則鉛泥中鉛元素的質量分數為___ %。簡述步驟⑦檢驗沉淀洗滌完全的方法___ 。
(4)已知水中鉛的存在形態主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)3-、Pb(OH)42-,其中Pb(OH)2是沉淀,各形態鉛的物質的量的分數α隨溶液pH變化的關系如圖所示,除去污水中的鉛,最好控制溶液的pH在____左右,當溶液的pH由13轉化為14時發生反應的離子方程式是:________________

(5)將PbO粗品溶解在HCl和NaCl的混合溶液中,得到含Na2PbCl4的電解液,進一步電解Na2PbCl4生成Pb,如圖所示。陰極電極反應式是_________

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲圖為一種新型污水處理裝置,該裝置可利用一種微生物將有機廢水的化學能直接轉化為電能;乙圖是含Cr2O72-酸性廢水的處理裝置。將甲、乙兩裝置連接[Fe(Ⅱ)極與X極連接],可將Cr2O72-轉化成Cr(OH)3沉淀而除去。下列說法錯誤的是
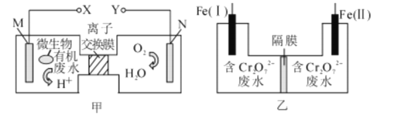
A.若廢水中含有乙醛,則M極的電極反應為:CH3CHO+2H2O-8e-=2CO2↑+8H+,
B.電解一段時間后,在Fe(I)極附近有沉淀析出
C.裝置乙的隔膜是陽離子交換膜
D.電路中每轉移3 mol電子,最多有0.5 mol Cr2O72-被還原
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知反應:
(1)該反應的生成物中含有的官能團的名稱是_______________,只含該官能團的物質在一定條件下不能發生的反應有_________(填序號);
①加成反應 ②酯化反應 ③氧化反應 ④還原反應
(2)已知HCHO分子中所有原子都在同一平面內,若要使![]() 分子中所有原子可能都在同一平面內,
分子中所有原子可能都在同一平面內,![]() 不能是_________(填序號);
不能是_________(填序號);
①![]() ②
②![]() ③
③![]()
(3)某氯代烴A的分子式為![]() ,它可以發生如下轉化:
,它可以發生如下轉化:

結構分析表明E分子中含有兩個甲基且沒有支鏈。
①A、C的結構簡式分別為:A_______________,C_______________;
②寫出下列轉化的反應方程式:A→B:__________________,D→E:_________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在2A(g)+B(g)![]() 3C(g)+4D(g)反應中,表示該反應速率最快的是
3C(g)+4D(g)反應中,表示該反應速率最快的是
A. v(A)=0.5mol/(L·s)B. v(B)=0.3mol/(L·s)
C. v(C)=0.8mol/(L·s)D. v(D)=1.0mol/(L·s)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知鎂能分別與O2、N2、CO2反應,反應的化學方程式分別是 2Mg+O2![]() 2MgO、3Mg+N2
2MgO、3Mg+N2![]() Mg3N2、2Mg+CO2
Mg3N2、2Mg+CO2![]() 2MgO+C。把等質量的金屬鎂分別放在:①足量純氧氣中;②足量二氧化碳氣體中;③足量空氣中,完全燃燒后,得到的固體物質的質量分別對應的是W1g、W2g和W3g。以下三者的關系正確的是( )
2MgO+C。把等質量的金屬鎂分別放在:①足量純氧氣中;②足量二氧化碳氣體中;③足量空氣中,完全燃燒后,得到的固體物質的質量分別對應的是W1g、W2g和W3g。以下三者的關系正確的是( )
A.W1>W2>W3B.W3=W1>W2C.W3>W2>W1D.W2>W1>W3
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com