
【題目】某工廠的廢渣中混有少量的鋅粉和氧化銅(其他成分不跟酸反應),跟大量廢鹽酸接觸形成污水,產生公害。若向污水中撒入鐵粉且反應后鐵粉有剩余,此時污水中一定含有的金屬離子是
A.Fe2+、Cu2+ B. Cu2+ 、 H+ C. Zn2+ 、Fe2+ D. Zn2+ 、H+
 全能測控期末小狀元系列答案
全能測控期末小狀元系列答案科目:高中化學 來源: 題型:
【題目】X、Y、Z、R、M是原子序數依次增大的五種元素,基態X原子的s電子數比p電子數多3個,Y、Z均位于第二周期且兩元素最外層電子數之和為11, Z、R同主族,M核外電子有26種運動狀態,請回答下列問題:
(1)化合物XCl3中心原子的雜化軌道類型為_______;RC12的立體構型為________。
(2)H2Z、H2R的沸點分別為100℃、-60.4℃,試解釋其原因:______________。
(3)R、M形成的一種化合物晶胞如圖所示。

① 該化合物的化學式為________;
② 若晶胞參數為a pm。列式計算該晶胞的密度ρ=_______g/cm3。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某工業廢料料中含有Cr(OH)3、Al2O3、CuO、NiO等物質,工業上通過下列流程回收其中有用的金屬和制取Na2Cr2O7。
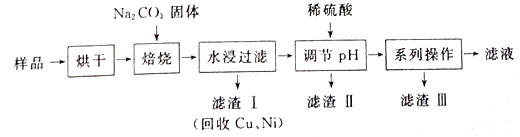
已知:
①“水浸過濾”后的溶液中存在Na2CrO4、NaAlO2等物質
②除去濾渣II后,溶液中存在反應2CrO42-+2H+![]() Cr2O72-+H2O
Cr2O72-+H2O
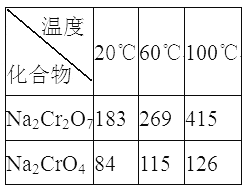
③Na2Cr2O7、Na2CrO4在不同溫度下的溶解度(g/100 g H2O)如下表:
(1)“焙燒”過程中生成NaAlO2化學方程式為_____________________。
(2)生成濾渣II時,需加入適量稀硫酸調節溶液的pH除去A1O2-。若稀硫酸過量,則因過量引起反應的離子方程式為______________________。
(3)“系列操作”為:繼續加入稀硫酸、_____、冷卻結晶、過濾。繼續加入稀硫酸的目的是_____________,濾渣III的主要成分是_________(填化學式)。
(4)工業上還可以在“水浸過濾’’后的溶液中加人適量稀硫酸,用石墨作電極電解生產金屬鉻,陰極的電極反應式為______________。
(5)流程圖最后的“濾液”中仍然有殘留的Na2Cr2O7。Cr為重金屬元素,若含量過高就排入河流中,會對河水造成重金屬污染。為測定“濾液”中的c(Na2Cr2O7),某實驗小組取“濾液”20mL,水稀釋至250 mL,再取稀釋后的溶液25 mL于錐形瓶中,用c mol L-1的FeSO4溶液進行氧化還原滴定,到終點時消耗FeSO4溶液體積為V mL[已知發生的反應為Na2Cr2O7 + FeSO4 + H2 SO4![]() Na2SO4+ Cr2(SO4) 3 + Fe2(SO4)3 + H2O(未配平)],則“濾液”中的(Na2Cr2O7)=______mol·L-1。
Na2SO4+ Cr2(SO4) 3 + Fe2(SO4)3 + H2O(未配平)],則“濾液”中的(Na2Cr2O7)=______mol·L-1。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】兩個體積相同的容器一個盛有CO2,另一個盛有N2和O2,在同溫同壓下兩容器內的氣體一定具有相同的()
A. 原子總數
B. 質子總數
C. 分子總數
D. 質量
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期元素A、B、C、D的原子序數依次增加。X、Y、Z、W分別是由這四種元素中的兩種組成的常見化合物,甲為單質,乙為紅棕色氣體,Y為淡黃色固體。上述物質之間的轉化關系如下圖所示(部分反應物或生成物省略),則下列說法中正確的是( )

A. 原子半徑:D>C>B>A
B. C. D的氫化物均為共價化合物
C. 相對分子質量W>X,沸點W>X
D. B的氫化物常溫下一定為氣態,C的氫化物常溫下為液態
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在密閉容器中發生如下反應:mA(g)+nB(g) ![]() pC(g),達到平衡后,保持溫度不變,將氣體體積縮小到原來的1/2,當達到新平衡時,C的濃度為原來的1.5倍,下列說法正確的是( )
pC(g),達到平衡后,保持溫度不變,將氣體體積縮小到原來的1/2,當達到新平衡時,C的濃度為原來的1.5倍,下列說法正確的是( )
A. ![]() B. 平衡向逆反應方向移動
B. 平衡向逆反應方向移動
C. A的轉化率減小 D. C的體積分數增加
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖是部分短周期元素的原子序數與其某種常見化合價的關系圖,若用原子序數代表所對應的元素,則下列說法正確的是 ( )

A. 31d和33d屬于同種核素
B. 氣態氫化物的穩定性:a>d>e
C. b、c、d、e四種元素中都存在能促進水的電離的含氧酸鹽
D. e和其它四種元素均能形成共價化合物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】【化學選修-物質結構與性質】
已知前四周期六種元素A、B、C、D、E、F的原子序數之和為107,且它們的核電荷數依次增大,B原子的p軌道半充滿,其氫化物沸點是同族元素中最低的,D原子得到一個電子后3p軌道全充滿,A與C能形成A2C型離子化和物,其中的陰、陽離子相差一個電子層,E4+離子和氬原子的核外電子排布相同.請回答下列問題:
(1)A、B、C、D的第一電離能由小到大的順序是______(填元素符號)
(2)化合物BD3的分子空間構型可描述為______,B的原子軌道雜化類型為______。
(3)已知F元素在人體內含量偏低時,會影響O2在體內的正常運輸.已知F2+與KCN溶液反應得F(CN)2沉淀,當加入過量KCN溶液時沉淀溶解,生成配合物.則F的基態原子價電子排布式為______。CN-與______(一種分子)互為等電子體,則1個CN-中π鍵數目為______。
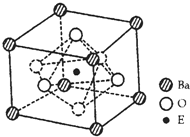
(4)EO2與碳酸鋇在熔融狀態下反應,所得晶體的晶胞結構如圖所示,則該反應的化學方程式為______,
在該晶體中,E4+的氧配為數為______。若該晶胞邊長為anm可計算該晶體的密度為______g/cm3(阿伏加德羅常數為NA)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】W、X、Y、Z、M、N六種主族元素,它們在周期表中位置如圖所示,下列說法不正確的是( )

A. 原子半徑:Y>Z>W
B. 單質的還原性:X>Y
C. 溴與元素M同主族,最高價氧化物的水化物的酸性比M的強
D. 元素N位于金屬與非金屬的分界線附近,可以推斷N元素的單質可作半導體材料
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com