
| A、等物質的量的弱酸HA與其鉀鹽KA的混合溶液中:2c(K+)=c(HA)+c(A-) |
| B、pH相同的CH3COONa溶液、Ba(OH)2溶液、KHCO3溶液:c(K+)>c(Na+)>c(Ba2+) |
| C、氨水中逐滴加入鹽酸得到的酸性溶液:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D、pH=3的一元酸HA溶液和pH=11的一元堿MOH溶液等體積混合:c(M+)=c(A-)>c(H+)=c(OH-) |


科目:高中化學 來源: 題型:
| A、2:1 | B、1:2 |
| C、3:2 | D、2:3 |
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、在0.1mol?L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
| B、在0.1mol?L-1Na2CO3溶液中:c(OH-)-c(H+)═c(HCO4-)+2c(H2CO3) |
| C、向0.2mol?L-1NaHCO3溶液中加入等體積0.1mol?L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| D、常溫下,pH=7的CH3COONa和CH3COOH混合溶液:c(Na+)+c(CH3COO-)═c(H+)+c(OH-) |
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
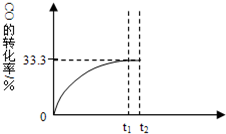 某溫度下,向密閉容器中充入2.0mol CO和1.0mol H2O,發生反應:
某溫度下,向密閉容器中充入2.0mol CO和1.0mol H2O,發生反應:查看答案和解析>>
科目:高中化學 來源: 題型:
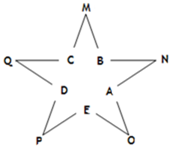 今有A、B、C、D、E五種常見單質,且相鄰的單質可生成對應的化合物M、N、O、P、Q(反應關系如圖所示),常溫下A呈氣態,其余均為固態,N分子中各原子均滿足八電子穩定結構;又知過量B與A作用產生白霧,B與過量A作用產生白煙;E在A中燃燒產生棕色的煙;Q遇水立刻水解產生白色絮狀沉淀和氣體,該沉淀能溶于氫氧化鈉溶液但不溶于氨水;P為黑色固體且能溶于稀鹽酸.試回答下列問題:
今有A、B、C、D、E五種常見單質,且相鄰的單質可生成對應的化合物M、N、O、P、Q(反應關系如圖所示),常溫下A呈氣態,其余均為固態,N分子中各原子均滿足八電子穩定結構;又知過量B與A作用產生白霧,B與過量A作用產生白煙;E在A中燃燒產生棕色的煙;Q遇水立刻水解產生白色絮狀沉淀和氣體,該沉淀能溶于氫氧化鈉溶液但不溶于氨水;P為黑色固體且能溶于稀鹽酸.試回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:
| A、原子半徑大小:Z>Y>X>W |
| B、Y、Z兩種元素的氧化物對應的水化物酸性為:Y<Z |
| C、X、Y、Z三種元素的單質均既有氧化性又有還原性 |
| D、W、Y、Z三種元素形成的氣態氫化物中最穩定的是Z的氣態氫化物 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com