
 2SO3(g)的混合體系中,SO3的百分含量和溫度的關系如下圖(曲線上任何一點都表示平衡狀態):
2SO3(g)的混合體系中,SO3的百分含量和溫度的關系如下圖(曲線上任何一點都表示平衡狀態):
 2SO3(g)的△H 0(填“>”或“<”);若在恒溫、恒壓時,向該平衡體系中通入氦氣平衡將 移動(填“向左”、“向右”或“不”);
2SO3(g)的△H 0(填“>”或“<”);若在恒溫、恒壓時,向該平衡體系中通入氦氣平衡將 移動(填“向左”、“向右”或“不”);
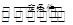 2NH3(g) △H=-2(Q2-Q1)KJ·mol-1
2NH3(g) △H=-2(Q2-Q1)KJ·mol-1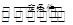 NH3(g) △H=-(Q2-Q1)KJ·mol-1)
NH3(g) △H=-(Q2-Q1)KJ·mol-1) NH3(g) △H =—(Q2—Q1)kJ?mol―l,若系數加倍,則N2(g)+3H2(g)
NH3(g) △H =—(Q2—Q1)kJ?mol―l,若系數加倍,則N2(g)+3H2(g) 2NH3(g) △H =—2(Q2—Q1)kJ?mol―l;根據電解質溶液中電荷守恒可知,溶液中c(H+)+c(NH4+)=c(Cl―)+c(OH―),由于25℃時溶液的pH=7,則c(H+)= c(OH―),因此溶液中c(NH4+)=c(Cl―);由于NH3?H2O+HCl=NH4Cl+H2O,假設a=b,酸堿完全中和后得到的NH4Cl是強酸弱堿鹽,所得溶液顯弱酸性,pH<7,因此鹽酸一定要不足,氨水一定要適當過量,所以a>b;(3)由于NaCl=Na++Cl―,則c(Cl―)=0.002mol?L―1,由于AgNO3=Ag++NO3―,則c(Ag+)=0.002mol?L―1;等體積混合后,c(Cl―)=0.001mol?L―1、c(Ag+)=0.001mol?L―1;由于AgCl(s)
2NH3(g) △H =—2(Q2—Q1)kJ?mol―l;根據電解質溶液中電荷守恒可知,溶液中c(H+)+c(NH4+)=c(Cl―)+c(OH―),由于25℃時溶液的pH=7,則c(H+)= c(OH―),因此溶液中c(NH4+)=c(Cl―);由于NH3?H2O+HCl=NH4Cl+H2O,假設a=b,酸堿完全中和后得到的NH4Cl是強酸弱堿鹽,所得溶液顯弱酸性,pH<7,因此鹽酸一定要不足,氨水一定要適當過量,所以a>b;(3)由于NaCl=Na++Cl―,則c(Cl―)=0.002mol?L―1,由于AgNO3=Ag++NO3―,則c(Ag+)=0.002mol?L―1;等體積混合后,c(Cl―)=0.001mol?L―1、c(Ag+)=0.001mol?L―1;由于AgCl(s) Ag++Cl―,則Qc(AgCl)=10―3 mol?L―1×10―3 mol?L―1=10―6 mol2?L―2> Ksp(AgCl),故有白色沉淀生成;由于Ksp(AgCl)> Ksp(AgI),根據沉淀轉化的規律可知,白色沉淀容易轉化為黃色沉淀,即AgCl(s)+I―
Ag++Cl―,則Qc(AgCl)=10―3 mol?L―1×10―3 mol?L―1=10―6 mol2?L―2> Ksp(AgCl),故有白色沉淀生成;由于Ksp(AgCl)> Ksp(AgI),根據沉淀轉化的規律可知,白色沉淀容易轉化為黃色沉淀,即AgCl(s)+I― AgI(s)+Cl―,該反應的平衡常數K=c(Cl―)/c(I―)="[" c(Ag+)?c(Cl―)]/[ c(Ag+)?c(I―)]=Ksp(AgCl)/Ksp(AgI)= 1.6×10―10/1.5×10―16=1.07×106>105,因此正反應幾乎進行到底,則該反應為AgCl(s)+I―=AgI(s)+Cl―。
AgI(s)+Cl―,該反應的平衡常數K=c(Cl―)/c(I―)="[" c(Ag+)?c(Cl―)]/[ c(Ag+)?c(I―)]=Ksp(AgCl)/Ksp(AgI)= 1.6×10―10/1.5×10―16=1.07×106>105,因此正反應幾乎進行到底,則該反應為AgCl(s)+I―=AgI(s)+Cl―。

科目:高中化學 來源:不詳 題型:單選題
| A.H2(g)的燃燒熱ΔH=-285.8 kJ·mol-1 |
| B.1molH2O(l)變成1mo1H2O(g),吸收88kJ能量 |
| C.3H2(g)+CO2(g)=CH3OH(l)+H2O(l)ΔH=+135.9 kJ·mol-1 |
| D.可以尋找特殊催化劑使H2O分解,同時放出能量 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:計算題

 CO2(g)+H2(g),得到如下三組數據:
CO2(g)+H2(g),得到如下三組數據:| 實驗組 | 溫度/℃ | 起始量/mol | 平衡量/mol | 達到平衡所需時間/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
 CO(NH2)2(l)+H2O(g)在合成塔中進行。下圖中Ⅰ、Ⅱ、Ⅲ三條曲線為合成塔中按不同氨碳比 [n(NH3)/n(CO2)]和水碳比[n(H2O)/n(CO2)]投料時二氧化碳轉化率的情況。
CO(NH2)2(l)+H2O(g)在合成塔中進行。下圖中Ⅰ、Ⅱ、Ⅲ三條曲線為合成塔中按不同氨碳比 [n(NH3)/n(CO2)]和水碳比[n(H2O)/n(CO2)]投料時二氧化碳轉化率的情況。


查看答案和解析>>
科目:高中化學 來源:不詳 題型:推斷題

查看答案和解析>>
科目:高中化學 來源:不詳 題型:計算題
| | 鉀 | 鈉 | Na2CO3 | 金剛石 | 石墨 |
| 熔點(℃) | 63.65 | 97.8 | 851 | 3550 | 3850 |
| 沸點(℃) | 774 | 882.9 | 1850(分解產生CO2) | ---- | 4250 |
 2 Na2CO3(l)+ C(s,金剛石) △H=-1080.9kJ/mol
2 Na2CO3(l)+ C(s,金剛石) △H=-1080.9kJ/mol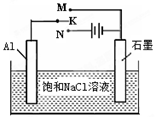
查看答案和解析>>
科目:高中化學 來源:不詳 題型:計算題
 CH3OH(g) △H1=-116 kJ·mol-1
CH3OH(g) △H1=-116 kJ·mol-1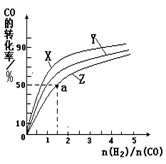

 O2(g)=CO2(g) △H2=-283 kJ·mol-1
O2(g)=CO2(g) △H2=-283 kJ·mol-1 O2(g)=H2O(g) △H3=-242 kJ·mol-1
O2(g)=H2O(g) △H3=-242 kJ·mol-1查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.3c–a-b | B.a+b-3c | C.a+3b-2c | D.a+3b-6c |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com