
我國化工專家侯德榜的“侯氏制堿法”曾為世界制堿工業做出了突出貢獻,他以NaCl、NH3、CO2等為原料先制得NaHCO3,進而生產出純堿。有關反應的化學方程式為:
NH3+CO2+H2O+NaCl NaHCO3↓+NH4Cl ;2NaHCO3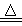 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
回答下列問題:
(1)氨氣、二氧化碳與飽和食鹽水反應,能析出碳酸氫鈉晶體的原因是 (填字母標號)。
a.碳酸氫鈉難溶于水
b.碳酸氫鈉受熱易分解
c.碳酸氫鈉的溶解度相對較小,所以在溶液中首先結晶析出
(2)某探究活動小組根據上述制堿原理,進行碳酸氫鈉的制備實驗,同學們按各自設計的方案實驗。
①一位同學將二氧化碳氣體通入含氨的飽和食鹽水中制備碳酸氫鈉,實驗裝置如下圖所示(圖中夾持、固定用的儀器未畫出)。
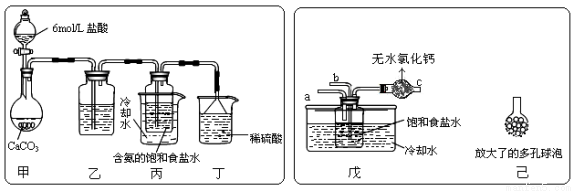
試回答下列有關問題:
 (Ⅰ)乙裝置中的試劑是 ;
(Ⅰ)乙裝置中的試劑是 ;
(Ⅱ)丁裝置中稀硫酸的作用是 ;
(Ⅲ)實驗結束后,分離出NaHCO3 晶體的操作是 (填分離操作的名稱)。
②另一位同學用圖中戊裝置(其它裝置未畫出)進行實驗。
(Ⅰ)實驗時,須先從 管通入 氣體,再從 管中通入 氣體;
(Ⅱ)有同學建議在戊裝置的b管下端連接己裝置,理由是 ;
科目:高中化學 來源:2016屆黑龍江省高三上期中測試化學試卷(解析版) 題型:選擇題
下列說法正確的是
A.增大壓強,活化分子百分數增加,化學反應速率一定增大
B.升高溫度,單位體積內分子總數不變,但活化分子數增加了
C.分子間所有的碰撞為有效碰撞
D.加入反應物,使活化分子百分數增加,化學反應速率增大
查看答案和解析>>
科目:高中化學 來源:2016屆河北省高三上學期四調考試化學試卷(解析版) 題型:選擇題
工業上常用電解硫酸鈉溶液聯合生產硫酸和燒堿溶液的裝置如圖所示,其中陰極和陽極均為惰性電極.測得同溫同壓下,氣體甲與氣體乙的體積比約為1:2,以下說法正確的是
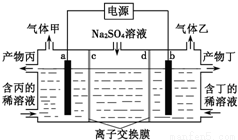
A.a極與電源的負極相連
B.產物丙為硫酸溶液
C.離子交換膜d為陰離子交換膜
D.a電極反應式:2H2O+2e-=H2↑+2OH-
查看答案和解析>>
科目:高中化學 來源:2016屆河北省高三上學期四調考試化學試卷(解析版) 題型:選擇題
用惰性電極電解某無色溶液時,有如下實驗現象:陽極上有無色氣體產生;陰極附近有白色沉淀生成。則原溶液中可能大量共存的離子組是
A.Na+、Ba2+、NO3-、Cl- B.H+、Mg2+、Na+、SO42-
C.CO32-、K+、Cl-、Na+ D.Fe2+、NO3-、SO42-、Na+
查看答案和解析>>
科目:高中化學 來源:2016屆江蘇省高三上學期第三次月考化學試卷(解析版) 題型:選擇題
鎂、鐵混合物13.4g溶解在足量的稀硝酸中,完全反應得到還原產物只有6.72L(標況下)NO,則向反應后的溶液中加人足量的NaOH溶液,可生成的沉淀質量為
A.26.8 g B.28.7 g C.29.1 g D.29.5g
查看答案和解析>>
科目:高中化學 來源:2015-2016學年甘肅省高一上期中測試化學試卷(解析版) 題型:填空題
(10分)現有下列儀器

(1)海水蒸餾是由海水獲得淡水的常用方法之一,在實驗室組成一套蒸餾裝置肯定需要上述儀器中的一部分,按照實驗儀器由下向上,從左到右的順序,這些儀器依次是 ;還缺少的玻璃儀器是 (填儀器名稱);儀器F的冷凝水應當從 口流出。
(2)海帶等藻類物質經過處理后可以得到碘水,欲從碘水中提取碘需要上述儀器中的(填字母) ;該儀器名稱為 ;向碘水中加入四氯化碳以提取碘單質的實驗操作稱為 ;靜置分層后,單質碘主要溶解在 (填溶劑名稱)中,該層此時的顏色為
查看答案和解析>>
科目:高中化學 來源:2015-2016學年西藏拉薩中學高二上第一次月考化學試卷(解析版) 題型:填空題
(1)CH3-CH3→CH2=CH2+H2,有關化學鍵的鍵能如下:
化學鍵 | C-H | C=C | C-C | H-H |
鍵能(kJ/mol) | 414.4 | 615.3 | 347.4 | 435.3 |
計算該反應的反應熱 (寫出計算過程)
(2)蓋斯定律在生產和科學研究中有很重要的意義。有些反應的反應熱雖然無法直接測得,但可通過間接的方法測定。現根據下列3個熱化學反應方程式:
Fe2O3(s)+3CO(g)= 2Fe(s)+3CO2(g) △H=-24.8kJ/mol
3Fe2O3(s)+ CO(g)=2Fe3O4(s)+CO2(g) △H=-47.2kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H=+640.5kJ/mol
寫出CO氣體還原FeO固體得到Fe固體和CO2氣體的熱化學反應方程式:
(3)發射衛星時可用肼(N2H4)為燃料,用二氧化氮為氧化劑,這兩種物質反應生成氮氣和水蒸氣。
已知:N2(g)+2O2(g)===2NO2(g) ΔH1=+67.7 kJ/mol
N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH2=-534 kJ/mol
試計算1 mol肼和二氧化氮完全反應時放出的熱量為__________________kJ,寫出肼與二氧化氮反應的熱化學方程式:______________________
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com