
 (1)反應A(g)+B(g)?C(g)+D(g)過程中的能量變化如圖所示(E1>0,E2>0),回答下列問題.
(1)反應A(g)+B(g)?C(g)+D(g)過程中的能量變化如圖所示(E1>0,E2>0),回答下列問題.分析 (1)①根據反應物與生成物總能量大小判斷反應吸放熱,反應熱△H=反應物的活化能-生成物的活化能;
②加入催化劑能降低反應的活化能;
(2)根據熱化學方程式的含義以及書寫方法來回答;
(3)①C3H8(g)→CH4(g)+HC≡CH(g)+H2(g)△H1=+156.6kJ•mol-1
②CH3CH=CH2(g)→CH4(g)+HC≡CH(g)△H2=+32.4kJ•mol-1
依據蓋斯定律①-②計算.
解答 解:(1)①由圖象可知該反應是一個能量降低的反應,所以屬于放熱反應;反應熱△H=反應物的活化能-生成物的活化能=E1-E2;
故答案為:放熱;E1-E2;
②加入催化劑改變了反應的途徑,降低反應所需的活化能,所以E1和E2均減小,故答案為:減小;減小;
(2)因1g丙烷完全燃燒生成液態水時放出50.45kJ的熱量,所以44g丙烷完全燃燒生成液態水,放出熱量2219.8KJ,
則丙烷完全燃燒的熱化學方程式:C3H8(g)+5O2(g )→3CO2(g )+4H2O(l)△H=-2219.8KJ/mol,
故答案為:C3H8(g)+5O2(g )→3CO2(g )+4H2O(l)△H=-2219.8KJ/mol;
(3)①C3H8(g)→CH4(g)+HC≡CH(g)+H2(g)△H1=+156.6kJ•mol-1
②CH3CH=CH2(g)→CH4(g)+HC≡CH(g)△H2=+32.4kJ•mol-1
依據蓋斯定律①-②得到C3H8(g)→CH3CH=CH2(g)+H2(g)△H=+124.2KJ/mol
故答案為:+124.2.
點評 本題考查反應熱的判斷、熱化學方程式和蓋斯定律計算應用,注意把握反應熱的計算方法、熱化學方程式的書寫方法以及蓋斯定律的含義,掌握基礎是關鍵,題目難度中等.


科目:高中化學 來源: 題型:選擇題
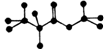
| A. | 該物質在酸性條件下水解生成乙酸 | |
| B. | 該物質含有雙鍵,能跟氫氣發生加成反應 | |
| C. | 該物質屬于酯類 | |
| D. | 分子式為C3H8O2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 甲 | 乙 | 丙 | 丁 | ||
| 密閉容器體積/L | 2 | 2 | 2 | 1 | |
| 起始物質的量 | n(SO2)/mol | 0.40 | 0.80 | 0.80 | 0.40 |
| n(O2)/mol | 0.24 | 0.24 | 0.48 | 0.24 | |
| SO2的平衡轉化率% | 80 | α1 | α2 | α3 | |
| A. | 甲中反應的平衡常數小于乙 | |
| B. | 該溫度下,該反應的平衡常數K為400 | |
| C. | SO2的平衡轉化率:α1>α2=α3 | |
| D. | 容器中SO3的物質的量濃度:丙=丁<甲 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1 mol任何物質所含有的原子數都相同 | |
| B. | 摩爾是物質的量的單位,簡稱摩,符號為mol | |
| C. | 摩爾可以把物質的宏觀數量與微觀粒子的數量聯系起來 | |
| D. | 國際上規定,0.012 kg C中所含有的碳原子數目為1摩 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
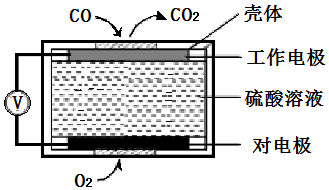
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
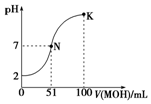 常溫下,向100mL 0.01mol•L-1 HA溶液中逐滴加入0.02mol•L-1 MOH溶液,圖中所示曲線表示混合溶液的pH變化情況(體積變化忽略不計).回答下列問題:
常溫下,向100mL 0.01mol•L-1 HA溶液中逐滴加入0.02mol•L-1 MOH溶液,圖中所示曲線表示混合溶液的pH變化情況(體積變化忽略不計).回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 腐乳是桂林有名的特產之一,請參考圖中的有關信息回答下列問題.
腐乳是桂林有名的特產之一,請參考圖中的有關信息回答下列問題. .腐乳雖好但不能作為主食,原因在于腐乳所含的糖類營養素較少,而該類營養素是人類生命活動所需能量的主要來源物質.
.腐乳雖好但不能作為主食,原因在于腐乳所含的糖類營養素較少,而該類營養素是人類生命活動所需能量的主要來源物質. .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com