
【題目】按溶液、濁液、膠體的順序排列正確的是( )
A.蘇打水、牛奶、豆漿B.碘酒、泥水、血液
C.白糖水、食鹽水、茶水D.石灰乳、澄清石灰水、石灰漿
科目:高中化學 來源: 題型:
【題目】25℃時,將agNH3完全溶于水,得到VmLpH=8的氨水,假設該氨水密度為ρg·cm3,溶質的質量分數為ω,其中含NH4+的物質的量為bmol,下列敘述中一定正確的是
A. 溶質的物質的量濃度c=![]() mol·L-1
mol·L-1
B. 溶質的質量分數為ω=![]() ×100%
×100%
C. c(OH-)=(![]() +10-8)mol·L-1
+10-8)mol·L-1
D. 為使溶液的質量分數等于0.5ω,應加入VmL水
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】I.SO2是一種重要的化工原料,其合理利用以及廢氣處理一直是化工研究的熱點。
(1)氧元素在元素周期表中位于第______周期______族,硫原子核外有_____種能量不同的電子。
(2)元素的非金屬性S比O______(填“強”或“弱”),從原子結構的角度解釋原因:__________。
II.工業上利用反應SO2 + MnO2 → MnSO4 可以制備高純 MnSO4,實驗裝置如下圖:

(3)請標出反應SO2 + MnO2 → MnSO4的電子轉移方向和數目____________
(4)在通入干燥空氣的條件下,一段時間后,測得反應后溶液中的 n(SO42-)明顯大于 n(Mn2+),請說明原因: ___________________。用化學方程式表示石灰乳的作用: ___________________。
III.SO2可用于處理含 Cr2O72-(鉻元素化合價為+6)的廢水,最后轉化為鉻沉淀(鉻元素化合價為+3)除去。一種處理流程如下:
![]()
(5)NaHSO3與 Cr2O72-反應時,物質的量之比為__________。
【答案】 二 ⅥA 5 弱 硫原子半徑大于氧原子半徑,硫原子和氧原子的最外層電子數相等,硫原子的得電子能力比氧原子弱  在溶液中,空氣中的氧氣將二氧化硫氧化為 H2SO4 SO2+ Ca(OH)2→CaSO3+ H2O(或2SO2+2Ca(OH)2+O2→ 2CaSO4 + 2H2O) 3∶1
在溶液中,空氣中的氧氣將二氧化硫氧化為 H2SO4 SO2+ Ca(OH)2→CaSO3+ H2O(或2SO2+2Ca(OH)2+O2→ 2CaSO4 + 2H2O) 3∶1
【解析】試題分析:(1)氧原子核外有2個電子層,最外層有6個電子,硫原子核外電子排布式是1S22S22P63S23P4;(2)同主族元素最外層電子數相同,原子半徑自上而下逐漸增大,得電子能力逐漸減弱,失電子能力逐漸增強;(3)反應SO2 + MnO2 → MnSO4中,硫元素化合價由+4升高為+6,錳元素化合價由+4降低為+2;(4)氧氣能把二氧化硫氧化為 H2SO4;二氧化硫污染空氣,用氫氧化鈣能吸收二氧化硫;(5)NaHSO3與 Cr2O72-反應時,硫元素化合價由+4升高為+6,鉻元素化合價由+6降低為+3,根據化合價升降相同計算物質的量之比。
解析:(1)氧原子核外有2個電子層,最外層有6個電子,所以氧元素在元素周期表中位于第二周期ⅥA族,硫原子核外電子排布式是1S22S22P63S23P4,有5個能級,所以有5種能量不同的電子;(2) 同主族元素最外層電子數相同,原子半徑自上而下逐漸增大,得電子能力逐漸減弱,失電子能力逐漸增強,所以S非金屬性比O弱;(3)反應SO2 + MnO2 → MnSO4中,硫元素化合價由+4升高為+6,硫失去2個電子,錳元素化合價由+4降低為+2,錳元素得到2個電子,所以電子轉移方向和數目是 ;(4)氧氣能把二氧化硫氧化為 H2SO4,所以反應后溶液中的 n(SO42-)明顯大于 n(Mn2+);二氧化硫污染空氣,氫氧化鈣能吸收二氧化硫,反應方程式為SO2+ Ca(OH)2→CaSO3+ H2O;(5)NaHSO3與 Cr2O72-反應時,硫元素化合價由+4升高為+6,鉻元素化合價由+6降低為+3,設NaHSO3與 Cr2O72-反應時的物質的量比為x∶y,根據化合價升降相同,2x=y×2×3,所以x∶y= 3∶1。
;(4)氧氣能把二氧化硫氧化為 H2SO4,所以反應后溶液中的 n(SO42-)明顯大于 n(Mn2+);二氧化硫污染空氣,氫氧化鈣能吸收二氧化硫,反應方程式為SO2+ Ca(OH)2→CaSO3+ H2O;(5)NaHSO3與 Cr2O72-反應時,硫元素化合價由+4升高為+6,鉻元素化合價由+6降低為+3,設NaHSO3與 Cr2O72-反應時的物質的量比為x∶y,根據化合價升降相同,2x=y×2×3,所以x∶y= 3∶1。
點睛:氧化還原反應中,氧化劑得電子化合價降低,還原劑失電子化合價升高,根據氧化還原反應的升降規律,氧化劑得電子數一定等于還原劑失電子數。
【題型】綜合題
【結束】
22
【題目】I.工業上可由氫氣、氮氣合成氨氣,溶于水形成氨水。鹽酸和氨水是實驗室常見的電解質溶液。一定溫度下,向2L 密閉容器中加入N2(g)和H2(g),發生反應:N2(g)+3H2(g)![]() 2NH3(g)+ Q(Q>0), NH3物質的量隨時間的變化如右圖所示。
2NH3(g)+ Q(Q>0), NH3物質的量隨時間的變化如右圖所示。

(1)0~2 min 內的平均反應速率 v(H2)=___________。
(2)該溫度下,反應 N2(g)+3H2(g)![]() 2NH3(g)+ Q(Q>0)的平衡常數表達式K=______。其平衡常數K與溫度T的關系如下表:
2NH3(g)+ Q(Q>0)的平衡常數表達式K=______。其平衡常數K與溫度T的關系如下表:
T/ ℃ | 25 | 125 | 225 |
平衡常數 K | 4×106 | K1 | K2 |
試判斷K1________K2(填寫“>”“=”或“<”)。
(3)下列能說明合成氨反應已達到平衡狀態的是______(填字母)(反應是在固定體積的密閉容器中進行的)
a.3v(N2) = v(H2)
b.容器內壓強保持不變
c.混合氣體的密度保持不變
d.25℃時,測得容器中c(NH3)=0.2 mol·L-1, c(H2) =c(N2) =0.01 mol·L-1
II.常溫下,某同學將鹽酸與氨水等體積混合,兩種溶液的濃度和混合后所得溶液的pH 如下表。
實驗編號 | 氨水濃度/mol·L-1 | 鹽酸濃度/mol·L-1 | 混合溶液 pH |
① | 0. 2 | 0.2 | pH=x |
② | c | 0.2 | pH=7 |
請回答:
(4)①中所得混合溶液, pH_______7(填“>”“<”或“=”)。
②中 c___0.2(填“>”“<”或“=”),所得混合溶液中各離子濃度大小關系為_____________。
(5)請你再設計一個能證明一水合氨是弱電解質的方案。_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖是部分短周期元素原子半徑與原子序數的關系圖。則下列說法正確的是
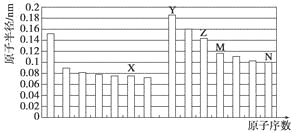
A. Z、N兩種元素的離子半徑相比,前者較大
B. X、N兩種元素的氣態氫化物的沸點相比,前者較低
C. 由X與M兩種元素組成的化合物不能與任何酸反應,但能與強堿反應
D. Z的氧化物能分別溶解于Y的氫氧化物和N的氫化物的水溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用下列實驗裝置進行相應實驗,能達到實驗目的的是:

A. 用圖(a)所示裝置除去氯氣中含有的少量氯化氫
B. 用圖(b)所示裝置蒸發氯化鈉溶液制備氯化鈉晶體
C. 用圖(c)所示裝置制取少量純凈的二氧化碳氣體
D. 用圖(d)所示裝置分離苯萃取碘水后已分層的有機層和水層
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列兩個熱化學方程式中,△H1 和△H2的相對大小正確的是( ) S(s)+O2(g)=SO2(g)△H1; S(g)+O2(g)=SO2(g)△H2 .
A.△H1>△H2
B.△H1<△H2
C.△H1﹦△H2
D.無法確定
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某廢催化劑含48.6% 的SiO2、16.2% 的ZnO、19.4% 的ZnS 和12 .8% 的CuS 及少量的Fe3O4。.某同學用10.0g該廢催化劑為原料,回收鋅和銅。采用的實驗方案如下,回答下列問題:

已知:金屬Zn 與Al類似,都是兩性金屬,能溶于強堿并放出氫氣,但鋁不溶于氨水,鋅卻可以溶于氨水形成四氨合鋅配離子[Zn(NH3)4]2+。
(1)濾液1中含有Fe2+,選用提供的試劑進行檢驗,檢驗方法如下:__________________________。(提供的試劑:稀鹽酸、KSCN 溶液、KMnO4 溶液、NaOH 溶液、K3[Fe(CN)6]溶液)
(2)濾渣2 除SiO2 外的另一成分是____________;第二次浸出時,加熱溫度不宜過高的原因是___________________;寫出第二次浸出的化學反應方程式____________________________________。寫出鋅溶于氨水的離子方程式____________________________________。
(3)ZnSO4在水中的溶解度,隨溫度的升高而緩慢增大,從硫酸鋅溶液得到七水硫酸鋅晶體,可采用的方法是_____________________;析出七水硫酸鋅晶體,減壓過濾,用于淋洗七水硫酸鋅晶體的溶劑是___________________;某同學在實驗完成之后,得到5.74gZnSO4·7H2O(式量287)則鋅的回收率為_______________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用滴有酚酞和氯化鈉溶液的濕潤濾紙分別做甲、乙兩個實驗,下列判斷正確的是

A. b、d兩極附近均有氣泡冒出
B. 甲乙中變紅色的電極均發生了還原反應
C. a、d兩極電極反應均為:Fe-2e-=Fe2+
D. 乙中鐵棒比甲中鐵棒更易腐蝕
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】汽車尾氣和燃煤造成空氣污染. 
(1)CO2是大氣中含量最高的一種溫室氣體,控制和治理CO2是解決溫室效應的有效途徑.目前,由CO2來合成二甲醚已取得了較大的進展,其化學反應是:2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g)△H=+QkJ/mol
①反應的平衡常數和溫度的關系如表:
溫度/℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常數 | 0.4 | 0.6 | 1.0 | 1.1 | 1.7 |
寫出該反應平衡常數表達式:K= .
向一個10L的密閉容器中充入10mol CO2和7molH2 , 830℃時測得H2為lmol,此時V (正)V (逆):(選填“>”、“<”)
②判斷該反應在一定溫度下,體積恒定的密閉容器中達到化學平衡狀態的依據是 .
A.容器中密度不變
B.容器內壓強保持不變
C.平均摩爾質量保持不變
D.v(CO2):v(H2)=1:3
E.單位時間內消耗2mol CO2 , 同時消耗1mol二甲醚
F.△H不變
(2)汽車尾氣凈化的主要原理為2NO(g)+2CO(g)2CO2(g)+N2(g).在密閉容器中發生該反應時,c(CO2)隨溫度(T)、催化劑的表面積(S)和時間(t)的變化曲線,如圖1所示.
①在T2溫度下,0~2s內的平均反應速率v(N2)=;
②當固體催化劑的質量一定時,增大其表面積可提高化學反應速率.若催化劑的表面積S1>S2 , 在上圖中畫出c(CO2)在T1、S2條件下達到平衡過程中的變化趨勢曲線.
(3)工業上用CO和H2合成 CH3OH:CO (g)+2H2(g)CH3OH (g)
①現在容積均為1L的a、b、c三個密閉容器中分別充入1mol CO和2mol H2的混合氣體,控制溫度進行反應,測得相關數據的關系如圖2所示.下列說法正確的是
a.正反應的△H>0
b.反應進行到5min時,b容器中v正=v逆
c.減壓可使甲醇的含量由b點變成c點
d.達到平衡時,a、b、c中CO的轉化率為b>a>c
②某溫度下,在體積固定的4L密閉容器中將1molCO和2molH2混合,測得不同時刻的反應前后壓強關系如表:
時間(min) | 5 | 10 | 15 | 20 | 25 | 30 |
壓強比(p后/p前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
達到平衡時CO的轉化率為
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com