
科目:高中化學 來源:2016-2017學年遼寧省鞍山市高一3月月考化學試卷(解析版) 題型:選擇題
一定量的KClO3中加入濃鹽酸發生如下反應:KClO3+6HCl(濃)=KCl+3Cl2↑+3H2O,其中氧化產物和還原產物的質量之比為
A. 1:6 B. 6:1 C. 5:1 D. 1:5
查看答案和解析>>
科目:高中化學 來源:2016-2017學年江蘇省揚州市高二第二次(3月)學業水平模擬測試化學試卷(解析版) 題型:選擇題
鋅空氣電池具有蓄電量大、充電循環次數多等優點。下列有關說法錯誤的是
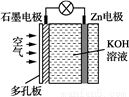
A. 電池放電時Zn電極逐漸溶解
B. 石墨為正極
C. 電子由石墨經導線流向Zn片
D. 電池放電時實現了化學能向電能的轉化
查看答案和解析>>
科目:高中化學 來源:2016-2017學年江蘇省揚州市高二第二次(3月)學業水平模擬測試化學試卷(解析版) 題型:選擇題
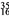 S可用于治療軟骨肉瘤,下列關于
S可用于治療軟骨肉瘤,下列關于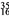 S的說法錯誤的是
S的說法錯誤的是
A. 質量數 B. 中子數19 C. 核電荷數35 D. 質子數16
查看答案和解析>>
科目:高中化學 來源:2017屆吉林省長白山市高三第二次模擬考試理綜化學試卷(解析版) 題型:填空題
霧霾天氣多次肆虐我國中東部地區。其中,汽車尾氣和燃煤尾氣是造成空氣污染的原因之一。
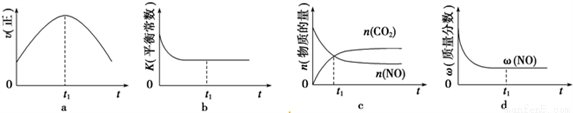
(1)汽車尾氣凈化的主要原理為2NO(g)+2CO(g) 2CO2(g)+N2(g)。在密閉容器中發生該反應時,c(CO2)隨溫度(T)、催化劑的表面積(S)和時間(t)的變化曲線,如下圖所示。據此判斷:
2CO2(g)+N2(g)。在密閉容器中發生該反應時,c(CO2)隨溫度(T)、催化劑的表面積(S)和時間(t)的變化曲線,如下圖所示。據此判斷:
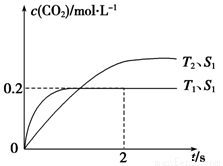
①該反應的△H_______0(填“>”或“<”),△S_______0(填“>”或“<”)。
②在T1溫度下,0~2s內的平均反應速率v(N2)=__________。
③當固體催化劑的質量一定時,增大其表面積可提高化學反應速率。若增大催化劑的表面積,則CO轉化率____(填“增大”、“減少”或“不變”)。
④若該反應在絕熱、恒容的密閉體系中進行,下列示意圖正確且能說明反應在進行到t1時刻達到平衡狀態的是__________(填字母)。
(2)直接排放煤燃燒產生的煙氣會引起嚴重的環境問題。
①煤燃燒產生的煙氣含氮的氧化物,用CH4催化還原NOX可以消除氮氧化物的污染。
例如:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867.0kJ·mol-1
2NO2(g) N2O4(g) △H=-56.9kJ·mol-1
N2O4(g) △H=-56.9kJ·mol-1
寫出CH4催化還原N2O4(g)生成N2和H2O(g)的熱化學方程式。____________。
②將燃煤產生的二氧化碳回收利用,可達到低碳排放的目的。下圖是通過人工光合作用,以CO2和H2O為原料制備HCOOH和O2的原理示意圖。電極a、b表面發生的電極反應式分別為
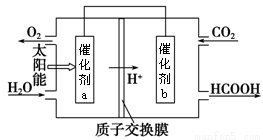
a:______________b:___________
查看答案和解析>>
科目:高中化學 來源:2017屆江西省新余市高三下學期第七次模擬考試理綜化學試卷(解析版) 題型:填空題
(1)W原子的核外電子排布式為_________。
(2)均由X、Y、Z三種元素組成的三種常見物質A、B、C分別屬于酸、堿、鹽,其化學式依次為_________、__________、_________,推測鹽中陰離子的空間構型為__________,其中心原子雜化方式為__________。
(3)Z、W兩種元素電負性的大小關系為____;Y、Z兩種元素第一電離能的大小關系為____。
(4)CO的結構可表示為C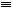 O,元素Y的單質Y2的結構也可表示為Y
O,元素Y的單質Y2的結構也可表示為Y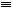 Y。右表是兩者的鍵能數據(單位:kJ·mol-1):
Y。右表是兩者的鍵能數據(單位:kJ·mol-1):
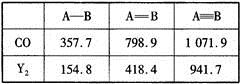
①結合數據說明CO比Y2活潑的原因:_____。
②意大利羅馬大學Fulvio Cacace等人獲得了極具研究意義的Y4分子,其結構如圖所示,請結合上表數據分析,下列說法中,正確的是_____。
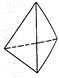
A.Y4為一種新型化合物 B.Y4與Y2互為同素異形體
C.Y4的沸點比P4(白磷)高 D.1 mol Y4氣體轉變為Y2將放出954.6kJ熱量
查看答案和解析>>
科目:高中化學 來源:2017屆江西省新余市高三下學期第七次模擬考試理綜化學試卷(解析版) 題型:選擇題
某種藥物合成中間體的結構簡式為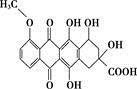 ,有關該物質的說法不正確的是( )
,有關該物質的說法不正確的是( )
A. 屬于芳香族化合物
B. 能發生消去反應和酯化反應
C. 能分別與金屬Na、NaHCO3溶液反應
D. 1 mol該有機物與足量Na2CO3溶液反應,消耗5 mol Na2CO3
查看答案和解析>>
科目:高中化學 來源:2016-2017學年山東省濰坊市高一下學期第一次月考模擬測試化學試卷(解析版) 題型:選擇題
與氫氧根離子具有相同的質子數和電子數的微粒是( )
A. CH4 B. NH4+ C. NH2- D. Cl-
查看答案和解析>>
科目:高中化學 來源:2017屆山東省菏澤市高三一模理綜化學試卷(解析版) 題型:簡答題
鉻是由法國化學家沃克蘭于1798年在巴黎發現的。目前鉻被廣泛應用于冶金、化工、鑄鐵、耐火及高精端科技等領域。
(1)鉻元素基態原子的電子排布式為____________,其核外未成對電子數為__________。
(2)金屬鉻的第二電離能(ICr)和錳的第二電離能(IMn)分別為1590.6kJ·mol-1、1509.0 kJ·mol-1,ICr>IMn的原因是__________。
(3)雷氏鹽(Reinecke salt)的化學式為NH4[Cr(NCS)4(NH3)2].H2O是一種易溶于水和乙醇的暗紅色固體。
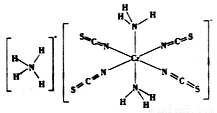
①雷氏鹽中鉻元素的化合價為_______,NH3與鉻離子形成的化學鍵為__________。
②NCS-的立體構型是________,其中碳原子的雜化軌道類型為_______。SO2、CO2、BaCl2、SCl2四種分子中,與NCS-互為等電子體的是_____________。
③乙醇的沸點比溴乙烷高,其原因是__________。
(4)硒化鉻的晶胞結構如圖所示,晶胞參數為anm和bnm,則硒化鉻的密度為____________g·cm-3(列出表達式即可)。

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com